
14.2. Термический анализ
Термический анализ и дифференциальный термический анализ (ДТА) заключаются в измерении температуры (или разности) в зависимости от количества подводимой или отводимой теплоты.
Рис
14.4.
Кривые
термического анализа:
/
— кривая термического анализа в
координатах T—t
(ДЯ
> 0 ); 2
—
кривая деривационного анализа в
координатах dT/di—t;
3
—
кривая дифференциального термического
анализа в координатах ЛТ—Т
(ДЯ<0)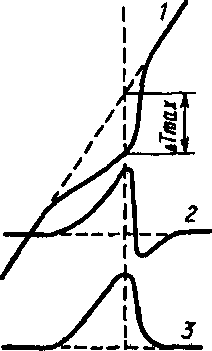
В методе ДТА температуру образца сравнивают с температурой некоторого инертного материала (эталона) в процессе линейного повышения окружающей температуры. Эталоном должно быть термически устойчивое вещество, для которого в интервале изучаемых температур не
наблюдается фазовых переходов или разложения. Для этих целей часто используют оксид алюминия (а- А1гО}).
При эндотермических в д лавтртття
0&70Я7»
лицея } \\
АГ'О
l
i ifЛ
Эндотермическая a&tcc/nt
процессах температура исследуемого образца падает ниже температуры эталона; для экзотермического процесса температура повышается (рис. 14.5).
Большинство превращений сопровождается эн- Рис. 14.5. Кривая ДТА с эндотермическим пи-дотермическими эффекта- ком при 7] и экзотермическим пиком при Т2 ми; исключение составляют процессы окисления и некоторые структурные изменения; довольно часто они возникают в результате вторичных процессов. В качестве примера рассмотрим разложение СаС204 Н,0 (рис. 14.6). Кривая 1 описывает разложение СаС204 - Н20 в атмосфере С02. Три точки потери массы соответствуют трем эндотермическим процессам — последовательному отщеплению Н20 , СО и С02. На кривой 2 наблюдается явно экзотермический пик, обусловленный сгоранием СО на воздухе при температуре печи.
разложении
СаС204
Н20
в ат- ДТд
можно
получить
с
ПОМощью
диф-
мосфере
С02
(1)
и
на воздухе (2) ференциально-калориметрических
из-
25- 3
87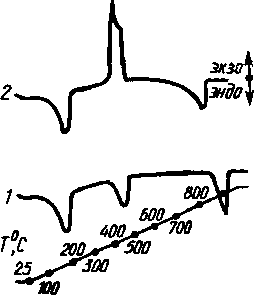
Т емпературы
пиков качественно характеризуют
соответствующие процессы. В количественном
методе ДТА принято одно основное
допущение: площадь, ограниченная
пиком на кривой, пропорциональна теплоте
реакции, а также количеству вступающего
в реакцию вещества. Это допущение обычно
не является достаточно строгим, поскольку
вид и положение пиков плохо воспроизводятся.
Поэтому основная область применения
ДТА — качественная оценка образцов.
Сначала этот метод применялся для
идентификации металлов, сплавов,
минералов, глин, керамических
материалов. В настоящее время его
используют для идентификации аминокислот,
белков, углеводов, полимеров, пищевых
продуктов.
емпературы
пиков качественно характеризуют
соответствующие процессы. В количественном
методе ДТА принято одно основное
допущение: площадь, ограниченная
пиком на кривой, пропорциональна теплоте
реакции, а также количеству вступающего
в реакцию вещества. Это допущение обычно
не является достаточно строгим, поскольку
вид и положение пиков плохо воспроизводятся.
Поэтому основная область применения
ДТА — качественная оценка образцов.
Сначала этот метод применялся для
идентификации металлов, сплавов,
минералов, глин, керамических
материалов. В настоящее время его
используют для идентификации аминокислот,
белков, углеводов, полимеров, пищевых
продуктов.
Количественную информацию а
то
воздухе,
сопровождающееся переходом
кристаллической решетки из ромбической
в гексагональную
м срсний,
используя для этого дифференциальный
сканирующий калориметр (ДСК). Обычно
в ДСК входит калориметр изотермического
типа. При таком способе измерения
различия в теплопроводности,
теплоемкости исследуемого образца
и эталона и другие отклонения не имеют
значения. На кривой ДСК пики имеют
правильную форму, тогда как на кривой
ДТА линейный участок кривой несколько
искажается тепловыми явлениями,
происходящими в образце. Сканирующий
калориметр удобен для определения
следов примесей в высокочистых
органических соединениях по результатам
наблюдения за понижением точки плавления.
На положение узловых точек чистых
веществ на Т—
//-диаграммах
влияют ничтожные примеси. Изменение
таких параметров твердых и жидких
веществ, как температуры замерзания и
кипения, давления пара растворов,
положено в основу методов определения
молекулярных масс н концентраций.
срсний,
используя для этого дифференциальный
сканирующий калориметр (ДСК). Обычно
в ДСК входит калориметр изотермического
типа. При таком способе измерения
различия в теплопроводности,
теплоемкости исследуемого образца
и эталона и другие отклонения не имеют
значения. На кривой ДСК пики имеют
правильную форму, тогда как на кривой
ДТА линейный участок кривой несколько
искажается тепловыми явлениями,
происходящими в образце. Сканирующий
калориметр удобен для определения
следов примесей в высокочистых
органических соединениях по результатам
наблюдения за понижением точки плавления.
На положение узловых точек чистых
веществ на Т—
//-диаграммах
влияют ничтожные примеси. Изменение
таких параметров твердых и жидких
веществ, как температуры замерзания и
кипения, давления пара растворов,
положено в основу методов определения
молекулярных масс н концентраций.
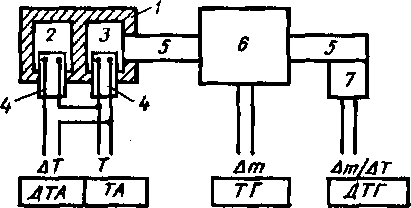
Результаты, полученные методами ТГ, ДТГ и ДТА, сравнива- Рис 14.8. Схема дериватографа:
. * / — печь; 2 — инертное вещество; 3 - проба; 4 —
ют при помощи дери- , :
r , г ~
г , , термоэлементы; 5 — плечи коромысла; 6 — весы; 7 —
ватографа (рис. 14.8). магнитная катушка
