- •Введение
- •1. Химическая термодинамика предмет и задачи термодинамики
- •1.1 Основные понятия и определения химической
- •1.2 Первый закон термодинамики
- •1.3 Применение первого закона термодинамики к процессам в любых системах
- •1.6 Теплоемкость. Связь теплоемкости с
- •1.7 Зависимость теплового эффекта oт температуры.
- •1.8 Второй закон термодинамики
- •1.9 Энтропия
- •1.10 Второй закон термодинамики для обратимых и
- •1.12 Постулат планка.Вычисление абсолютной энтропии
- •1.14 Энергия гельмгольца (изохорно-изотермический
- •1.15 Энергия гиббса (изобарно-изотермический
- •1.16 Уравнение гиббса-гельмгольца
- •1.17 Характеристические функции
- •1.18 Химический потенциал.Летучесть
- •1.20 Уравнение изотермы реакции
- •1.21 Зависимость константы равновесия от температуры
- •1.23 Тепловая теорема нернста
- •1.24 Расчет химического равновесия с помощью
- •2. Фазовые равновесия
- •2.1 Общие понятия
- •2.2 Условия фазового равновесия
- •2.3 Правило фаз гиббса
- •2.4 Уравнение клаузиуса-клапейрона
- •2.5 Однокомпонентная система воды
- •2.6 Диаграммы состояния двухкомпонентных
- •2.6.1 Система с неограниченной растворимостью
- •2.6.3 Система с ограниченной растворимостью
- •2.7 Трехкомпонентные системы
- •3. Растворы
- •3.1 Характеристика растворов
- •3.2 Закон рауля
- •3.5 Жидкие бинарные системы. Идеальные растворы
- •3.6 Растворы с положительными и отрицательными
- •3.7 Состав паровой фазы над растворами. Законы
- •3.7.1 Диаграммы состав – давление пара (температура
- •3.7.2 Перегонка. Ректификация
- •Ректификация
- •3.8 Термодинамика концентрированных
- •3.10 Растворимость твердых тел в жидкостях
- •3.12Распределение растворенного вещества между
- •4.2 Математическое описание волнового движения
- •4.3 Уравнение шредингера
- •4.4 Решение уравнения шредингера
- •4.7 Распространение волнового уравнения на
- •4.8 Атомные термы
- •5.1 Ионная связь.Энергия кристаллической решетки
- •5.2 Ковалентная связь
- •5.4 Расчет молекулярного иона водорода
- •5.7 Квантовохимические представления о координационных соединениях
- •5.9 Водородная связь
- •6.1 Дипольный момент молекул
- •Содержание
- •1.Химическая термодинамика
- •2.Фазовые равновесия
- •3.Растворы
- •4.Строение атомов
- •5.Химическая связь
- •6.Электрические и магнитные свойства молекул
3.5 Жидкие бинарные системы. Идеальные растворы
Рассматриваются законы равновесия между жидкой и паровой фазами систем, образованных двумя достаточно летучими и неограниченно растворимыми друг в друге компонентами.
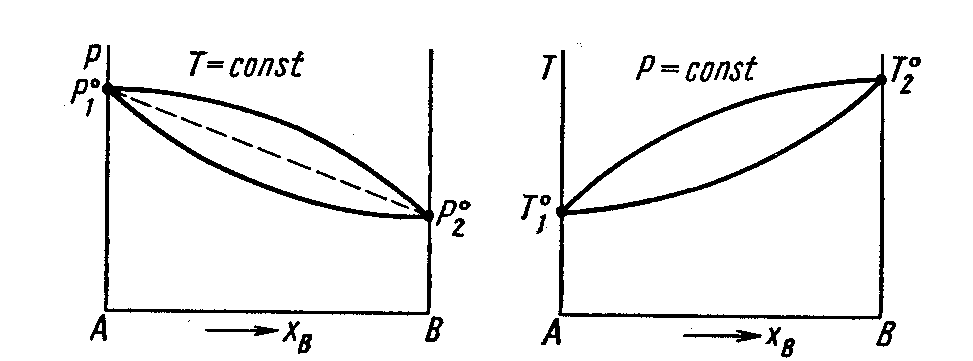
Наибольший интерес представляют диаграммы: состав- давление пара и состав-температура кипения.
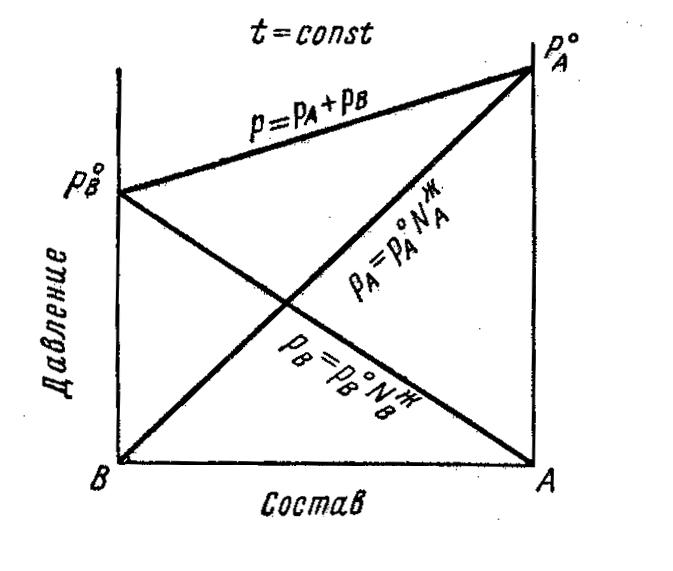
При заданной температуре общее давление Р раствора складывается из парциальных давлений РА и Рв компонентов
Р = Pа + Рв
Различают три группы растворов - идеальные, предельно разбавленные и неидеальные.
Идеальным называется раствор, в котором силы взаимодействия FА.В между молекулами разных видов равны силам взаимодействия FA-A и FB-B между молекулами одного вида. Поведение идеального раствора, подобно поведению идеального газа, зависит только от концентрации компонентов и температуры.
Согласно закона Рауля
Pi = Рi°NiЖ
Р = Ра + Рв = РА0 NAЖ+ РВ0 NBЖ= РА°NАЖ + РB0 (1 - NAЖ) =
== РВ0 + NAЖ(PA0 – PB0)
Неидеальные растворы FB-B FA.B FA.A
Предельно разбавленные растворы - растворы, в которых концентрация растворенного вещества бесконечно мала.
Pi = Pi0NiЖ
Р2 = K2N2 (закон Генри)
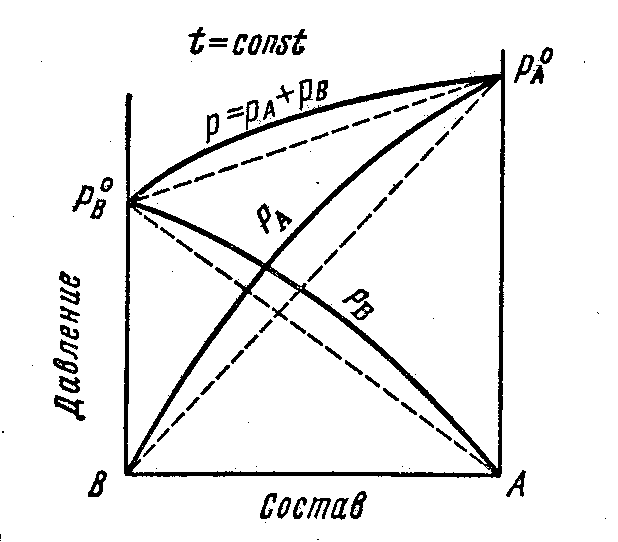
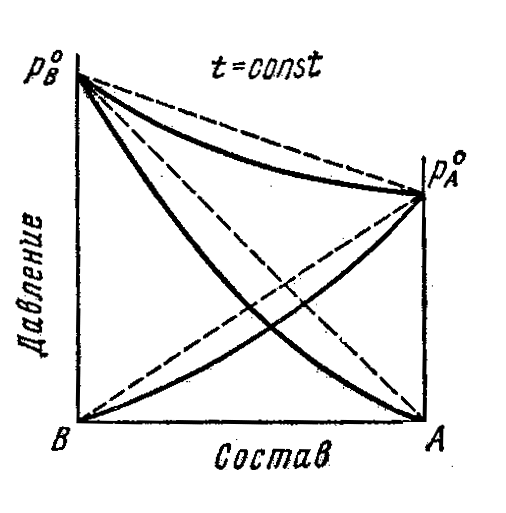
3.6 Растворы с положительными и отрицательными
ОТКЛОНЕНИЯМИ ОТ ЗАКОНА РАУЛЯ
FB-B FA-B FA-A FB-B FA-B FA-A
3.7 Состав паровой фазы над растворами. Законы
КОНОВАЛОВА
Первый закон Коновалова. В общем случае относительное содержание данного компонента в паре отличается от относительного содержания этого компонента в равновесном с ним жидком растворе. В паре больше того компонента, добавление которого в раствор повышает общее давление пара
P1 = P10 N1Ж
Р2 = P2°(l-NiЖ)
=
![]()
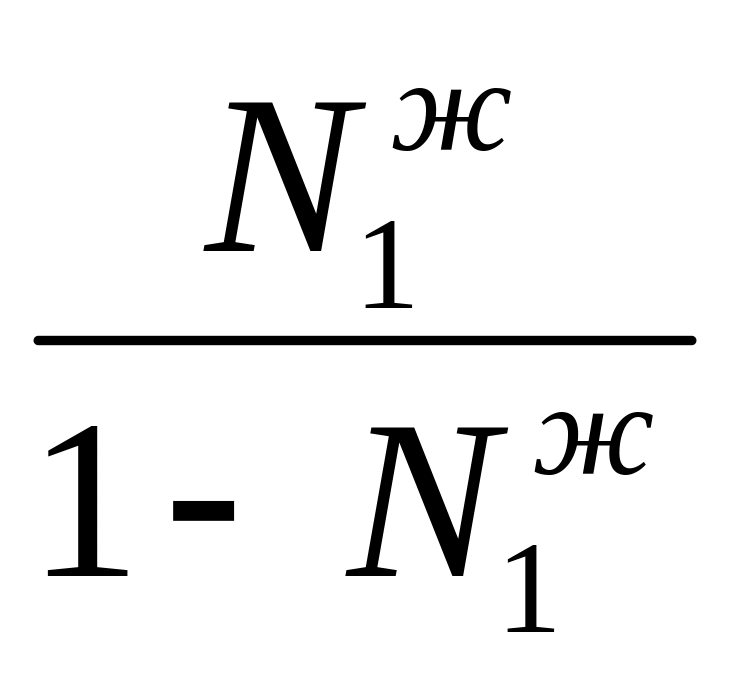
Р1V = N1 n RT
P2V = N2nRT =(1- N1n)RT
=
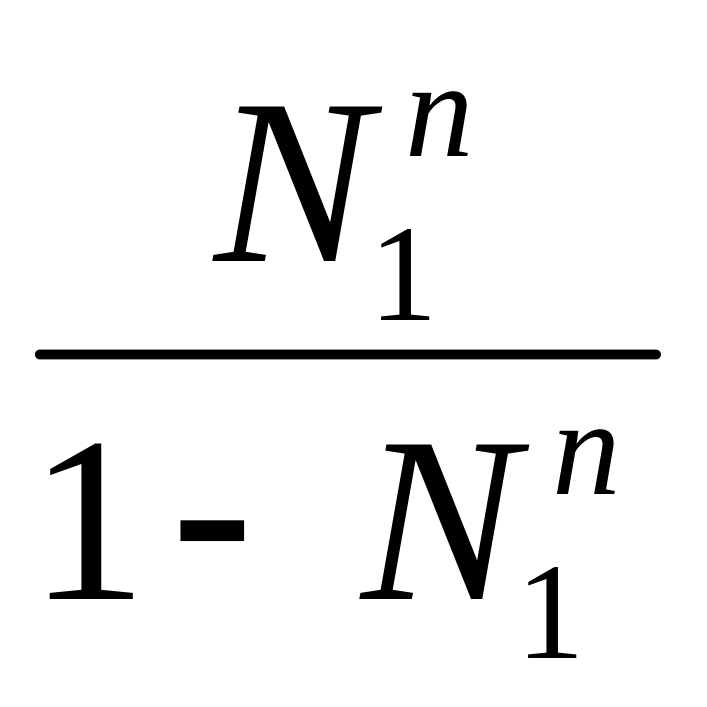
=
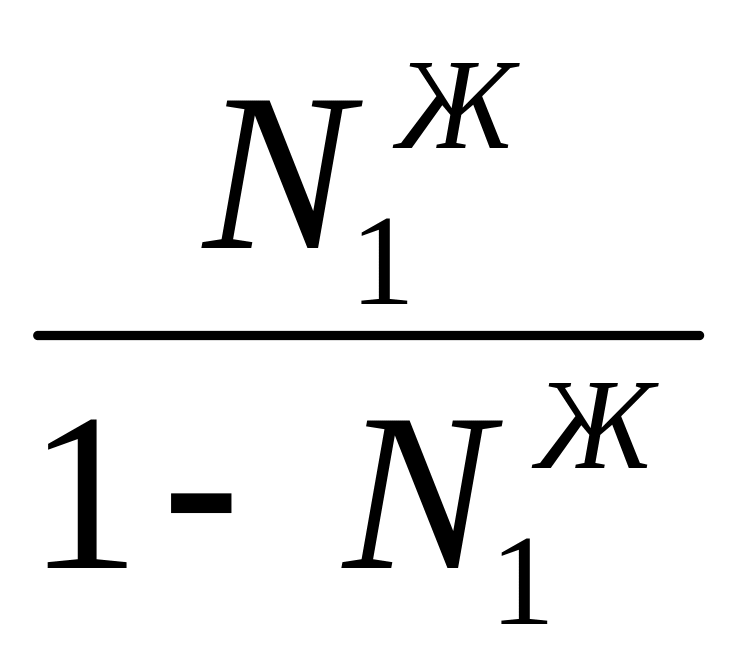
Очевидно, что составы жидкости и пара могут быть одинаковыми только при
Р10 = Р20
Уравнение показывает, что для идеальной двойной системы пар будет всегда относительно богаче более летучим компонентом по сравнению с раствором, с которым он находится в равновесии.
Если Р1°>Р2°(то
![]()
![]()
Nn1>N1Ж-
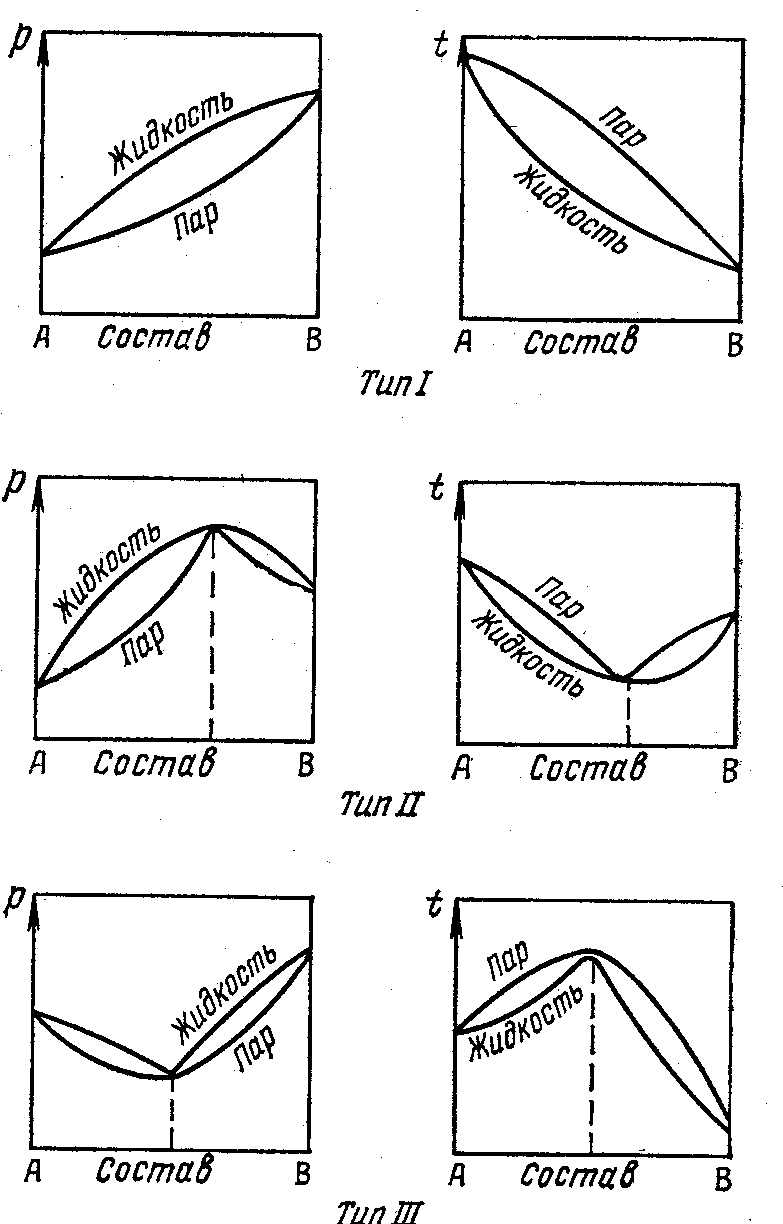
Второй закон Коновалова - Экстремумы на кривых общего давления пара или температуры кипения отвечают такому равновесию раствора и его насыщенного пара, при котором составы обеих фаз одинаковы.
3.7.1 Диаграммы состав – давление пара (температура
КИПЕНИЯ)
Совокупность равновесных состояний в двойной жидкой системе обычно изображается изотермической диаграммой ,на которой наносятся кривые зависимости общего давления пара (температуры) как от состава жидкости, так и от состава пара.