
- •Глава 1. Строение атома. Периодическая система и Периодический закон д.И.Менделеева.
- •1.1. Модель атома по Резерфорду. Постулаты Бора.
- •1.2. Корпускулярно-волновые свойства микромира.
- •Квантовые числа
- •1.3. Электронные оболочки атомов.
- •1.4. Периодическая система элементов д.И.Менделеева.
- •1.5. Периодичность свойств элементов
- •Глава 2. Химическая связь.
- •2.1. Общие положения.
- •2.2. Метод валентных связей
- •2.3. Метод молекулярных орбиталей
- •Глава 3. Основы химической термодинамики.
- •3.1. Основные определения.
- •3.2. Первый закон (начало) термодинамики. Энтальпия системы.
- •3.3. Закон Гесса
- •3.4.Второй закон (начало) термодинамики
- •3.5. Свободная энергия Гиббса
- •3.6. Химический потенциал
- •Глава 4. Основы кинетики. Химическое равновесие.
- •4.1. Скорость химической реакции.
- •4.2. Факторы, влияющие на скорость химической реакции
- •4.3. Химическое равновесие.
- •Глава 4. Основы кинетики. Химическое равновесие.
- •4.1. Скорость химической реакции.
- •4.2. Факторы, влияющие на скорость химической реакции
- •4.3. Химическое равновесие.
- •Глава 5. Растворы.
- •5.1. Общая характеристика и классификация растворов.
- •5.2. Растворение как физико-химический процесс
- •5.3. Растворимость
- •5.4. Способы выражения концентрации растворов
- •5.5.Коллигативные свойства растворов.
- •I закон Рауля
- •II закон Рауля
- •Осмос. Осмотическое давление.
- •5.6. Растворы электролитов. Электролитическая диссоциация.
- •Степень электролитической диссоциации
- •5.7. Основы теории растворов сильных электролитов
- •5.8. Электролитическая диссоциация воды.
- •5.9. Амфотерные гидроксиды.
- •5.10. Протолитические реакции.
- •5.11. Произведение растворимости.
- •Глава 6. Электрохимия металлов
- •Зависимость электродного потенциала от концентрации веществ выражается уравнением Нернста:
- •6.2.1. Катодные процессы
- •6.2.2. Анодные процессы При рассмотрении анодных процессов следует различать электролиз с инертным анодом и электролиз с активным анодом, т.Е. Материал которого может окисляться.
- •6.2.3. Законы электролиза
- •6.3. Коррозия металлов
- •6.3.1. Пассивное состояние металлов
- •6.3.2. Классификация методов защиты от коррозии
5.6. Растворы электролитов. Электролитическая диссоциация.
Понятие об электролитах и неэлектролитах было введено Фарадеем в первой половине Х1Х в. Теорию электролитической диссоциации предложил шведский ученый Аррениус в 1887 г.
Электролитами называются вещества, распадающиеся на ионы в растворах и расплавах. Основная особенность растворов электролитов – они проводят электрический ток. Ионы, заряженные положительно, называются катионами, а отрицательно заряженные – анионами.
Электролитической диссоциацией называется процесс распада электролита на ионы под действием полярных молекул растворителя.
Взаимодействие ионов с полярными молекулами растворителя называется сольватацией (для водных растворов – гидратацией).
Явление электролитической диссоциации объясняется тем, что взаимодействие полярных молекул растворителя с молекулами растворенного вещества с полярной связью, например, хлоридом водорода, приводит к ослаблению связи между атомами, образующими молекулы вещества, и их распаду на ионы (см. рис. 5.4). Ионная кристаллическая решетка разрушается полярными молекулами растворителя за счет электростатического
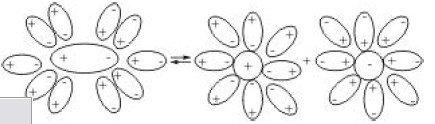
Рис.5.4. Схема диссоциации полярной молекулы в растворе на ионы.
взаимодействия с ионами, из которых построены твердые соли. Т. е. растворение ионного кристалла всегда сопровождается электролитической диссоциацией.
Процесс диссоциации электролита КА может быть записан так:
К+А-- + х Н2О К+. (Н2О)к + А- . (Н2О)а.
Процесс электролитической диссоциации можно охарактеризовать:
степенью электролитической диссоциации ;
изотоническим коэффициентом i;
константой диссоциации К.
Степень электролитической диссоциации
Степень электролитической диссоциации – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
α= N/No, (5.5)
где α— степень электролитической диссоциации, N0 — число растворенных молекул, а N — число молекул, распавшихся на ионы.
Степень диссоциации может измеряться в долях единицы или в процентах.
По степени диссоциации электролиты делятся на сильные, средние и слабые.
Если 30%, то это сильные электролиты. К ним относятся соли; кислоты: соляная, серная, азотная, бромистоводородная, ионистоводородная, хлорная; щелочи: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Для электролитов средней силы 3%30%. К ним относятся фосфорная и сернистая кислоты.
Для слабых электролитов 3%. К ним относятся:
кислоты: H2CO3, HCN, H2S, все органические кислоты. Из щелочей – NH4OH.
Степень диссоциации зависит от природы растворенного электролита и растворителя, концентрации раствора и температуры.
Факторы, влияющие на степень электролитической диссоциации
Природа растворенного вещества. Под природой растворенного вещества в данном случае подразумевают природу химической связи в молекулах растворенных веществ. Чем более полярна химическая связь, тем выше степень диссоциации. Вещества с ионной химической связью относятся к сильным электролитам. Ковалентной полярной связью обладают, как правило, средние и слабые электролиты.
Природа растворителя. Чем более полярный растворитель, тем выше степень диссоциации растворенного вещества. Мерой полярности молекул растворителя может служить величина их дипольного момента. Но полярность растворителя в целом лучше характеризует диэлектрическая постоянная, т.е. величина, показывающая, во сколько раз сила взаимодействия двух зарядов в данной среде меньше, чем в вакууме. Если растворить хлороводород в воде и спирте, то в спирте степень диссоциации его меньше, поэтому кислотные свойства хлороводорода в спиртовом растворе будут выражены слабее.
Концентрация растворенного вещества. Увеличение содержания растворенного вещества в растворе приводит к уменьшению степени его диссоциации, так как молекула растворенного вещества будет взаимодействовать с меньшим количеством молекул растворителя.
Степень диссоциации принимает максимальное значение =1 в бесконечно разбавленном растворе.
Температура. При повышении температуры степень диссоциации увеличивается. Это происходит потому, что с повышением температуры увеличивается амплитуда колебания атомов в молекуле и связь между ними ослабевает. Одновременно увеличивается скорость движения молекул растворителя и их кинетическая энергия, что также способствует распаду молекул растворенного вещества на ионы за счет большего числа их столкновений с молекулами растворителя.
Наличие в растворе одноименных ионов. Добавление к раствору слабой кислоты ее соли или более сильной кислоты приводит к уменьшению степени диссоциации. Причину этого уменьшения легко объяснить, применив принцип Ле Шателье к равновесию:
HA H+ +A- .
Увеличение концентрации любого из продуктов диссоциации приводит к сдвигу равновесия влево и увеличению концентрации непродиссоциировавших молекул кислоты. Это в свою очередь, означает уменьшение степени диссоциации.
Изотонический коэффициент (коэффициент Вант-Гоффа)
i – это отношение суммы числа ионов и непродиссоциировавших молекул электролита к начальному числу молекул электролита.
Обозначим:
N – число растворенных молекул;
- степень диссоциации;
n – число ионов, на которые распадается одна молекула электролита.
Тогда: N – число молекул, распавшихся на ионы; Nn – число образовавшихся ионов; N(1 - ) –число молекул не распавшихся на ионы; Nn + N(1 - ) - общее число частиц в растворе.
I = Nn +N(1 - / N = n + (1 - = 1 + (n – 1).
Отсюда:
(i –1) /(n – 1). (5.6)
Из-за диссоциации общее число частиц в растворе электролита больше, чем в растворе неэлектролита той же концентрации, поэтому осмотическое давление, повышение температуры кипения и понижение температуры замерзания для раствора электролита будут выше, чем для раствора неэлектролита той же концентрации (все эти величины зависят только от числа частиц в растворе).
Неэлектролиты i=1 |
Электролиты i |
Р =Р0N2 |
iP0N2 |
tкрист= Ккcm |
Dtкип= Кэcm |
tкип= Кэcm |
tкип=iКэcm |
π= cMRT |
π=icMRT |
i = /tкрист/tкрист = tкип/tкип = π/π.
Величины в числителе определяют экспериментально, в знаменателе вычисляют по соответствующим формулам:
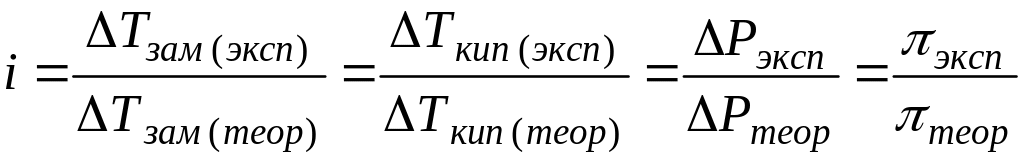
Константа электролитической диссоциации.
В растворах слабых электролитов процесс диссоциации протекает обратимо и устанавливается равновесие, которое можно охарактеризовать константой равновесия К:
КА К+ + А-
ККА = К+-,
где +, - и - концентрации в растворе ионов К+, А- и непродиссоциировавших молекул КА ( в моль/л).
Для данного электролита значение К постоянно при определенной температуре и в отличие от не зависит от концентрации.
Установим связь между К, и сМ для бинарного электролита (т.е. распадающегося на два иона).
Концентрация ионов К+ и А- в растворе +-= сМ, концентрация непродиссоциировавших молекул в КА растворе сМ,, откуда
К = 2сМ2/(1 - )сМ или К = 2сМ/(1 - ).
Последнее уравнение выражает закон разбавления Оствальда.
Если , то ( 1 - ) и тогда
сМ.
Как видно из последнего уравнения, с уменьшением концентрации электролита в растворе степень электролитической диссоциации возрастает (одна из формулировок закона Оствальда).
Диссоциация слабых многоосновных кислот и многокислотных оснований протекает ступенчато, каждая стадия диссоциации характеризуется ступенчатой константой диссоциации.
H2CO3 H+ + HCO3-
K1 = +C3-2C3 = 4,45 10-7 (25o C).
HCO3- H+ + CO32-
K2 = +C32-C3- = 4,70 10-11 (25o C).
Как видно из этих данных, процесс диссоциации слабого электролита протекает, в основном, по первой стадии.
