
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Южно-Уральский государственный университет» (национальный исследовательский университет)
Химический факультет
Кафедра «Экология и природопользование»
Отчет по лабораторной работе № 2
Коагулирование природных вод
Проверил: к.х.н.,
доцент кафедры ЭкиП
Т.Г. Крупнова
2012 г
Автор работы
Студент группы Х – 113м
Т.С. Бухарина
2012 г
Челябинск 2012
Коагулирование природных вод
Основной задачей очистных сооружений городских водопроводов, пользующихся речными и озерными водами, является осветление и обесцвечивание воды (удаление из нее коллоидных и взвешенных веществ). Процесс взаимного слипания частиц, их укрупнения, называется коагуляцией, а реагенты, используемые для этой цели – коагулянты. При обработке природных вод наибольшее распространение из коагулянтов получили сернокислые и хлористые соли алюминия и железа. При введении в воду сернокислого алюминия сначала происходит диссоциация соли:
Al2(SO4)3 ↔ 2Al3+ + 3SO42-.
Трехвалентные катионы алюминия подвергаются затем гидролизу за счет гидроксильных ионов, находящихся в воде, образуя практически нерастворимую гидроокись алюминия:
Al3+ + H+ + OH– ↔ [AlOH]2+ + H+,
[AlOH]2+ + H+ + OH– ↔[Al(OH)2]+ + H+,
[Al(OH)2]+ + H+ + OH– ↔ Al(OH)3 + H+,
Al3+ + 3H2O ↔ Al(OH)3 + 3H+.
Образующаяся гидроокись алюминия Al(OH)3 имеет весьма развитую поверхность и обладает адсорбционными свойствами, поэтому находщиеся в воде примеси сорбируются гидроокисью алюминия, в результате чего вода осветляется и обесцвечивается. В процессе коагуляции хлопья гидроокиси с прилипшими к ним примесями постепенно укрупняются, что облегчает их последующее выделение из воды.
Выделяющиеся при гидролизе ионы водорода вступают в реакцию с присутствующими в воде гидрокарбонатными ионами:
H+ + HCO3– ↔ H2CO3 ↔ H2O + CO2.
Если карбонатов, содержащихся в воде, не хватает для полного гидролиза коагулянта, то производят ее подщелачивание. Дозу извести для этого определяют по формуле 1:
Диз = 28(Дк/е – Щ + 1), мг/л, |
(1) |
где Диз – доза извести, мг/л;
Дк – доза коагулянта;
е – эквивалентный вес коагулянта;
Щ – щелочность в исходный воде, мг-экв/л.
Если Диз получается отрицательным, то подщелачивание не производят.
Суммарная реакция гидролиз сульфата алюминия в присутствии находящегося в природных водах бикарбоната кальция выражается уравнением:
Al2(SO4)3 + 3Ca(HCO3)2 + 6H2O = 2Al(OH)3 + 3CaSO4 + 6H2CO3.
Наиболее эффективная коагуляция происходит при полном гидролизе коагулянта, происходящем при рН воды в пределах 6,5–7,5.
При предварительных расчетах для обработки воды дозу сернокислого алюминия рассчитывают по формуле 2:
Дк
= 4 |
(2) |
где Дк – доза коагулянта, мг/л;
Ц – цветность воды, град,
или по формуле 3:
Дк
= 3,5 |
(3) |
где М – мутность воды, мг/л.
Оптимальную дозу коагулянта определяют путем пробного коагулирования в лабораторных условиях.
ПОРЯДОК ВЫПОЛНЕНИЯ ЛАБОРАТОРНОЙ РАБОТЫ
Для выполнения работы была выдана проба исследуемой воды (I).
Определение качественных показателей исходной воды.
1.Определение цветности воды
Цветность измеряют в градусах платиново-кобальтовой шкалы цветности путем сравнения исследуемой воды с эталоном. В эталонную колбу наливают примерно 500 мл и рассматривают сбоку на белом фоне на расстоянии 2 м, подбирая к цвету пробы цвет наиболее подходящей колбы шкалы цветности.
Цветность исследуемой воды составляет 100 град.
2. Определение активной реакции рН
Для определения рН используют индикаторную бумагу, которая представляют собой обычную фильтровальную бумагу, пропитанную раствором того или иного универсального индикатора (лакмус). Универсальная индикаторная бумага рассчитана на определение величины рН в интервале от 1 до 10. К каждой пачке индикаторной бумаги обычно прилагается цветная шкала, показывающая окраску бумаги при различных рН.
Активная реакция исследуемой воды: рН = 7.
3. Определение общей щелочности воды
Общая щелочность воды обусловлена суммой содержащихся в воде ионов НСО3–, СО32–, ОН– и других солей слабых кислот, вступающих в реакцию с сильными. Щелочность, обусловленная присутствием сильных оснований (гидратов), называется гидратной. Щелочность, обусловленная присутствием ионов НСО3–, СО32– называется бикарбонатной, или карбонатной. Для природных вод характерна бикарбонатная щелочность. Щелочность выражается в мг-экв/л. Практически щелочность природных вод соответствует концентрации гидрокарбонатных ионов НСО3– если в воде отсутствуют карбонаты СО32–.
Определение общей щелочности основано на реакции образования нейтральных солей при титровании воды соляной кислотой. Ионы оттитровывают соляной кислотой в присутствии индикатора фенолфталеина, они обусловливают щелочность воды по фенолфталеину. При этом протекают следующие реакции:
ОН– + Н+ ↔ Н2О,
СО32– + Н+ ↔ НСО3–.
Ион НСО3– оттитровывают соляной кислотой в присутствии индикатора метил-оранжа. При этом происходит реакция:
НСО3– + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑.
Если щелочность по фенолфталеину равна нулю, то общая щелочность обусловлена только НСО3– и равна карбонатной жесткости, так как в природных водах ионы НСО3– связаны только с ионами Ca2+ и Mg2+.
Реактивы и оборудование
1. коническая колба емкостью 250 мл;
2. индикатор метиловый оранжевый;
3. индикатор фенолфталеин
4. 0,1Н раствор HCl.
К 50 мл испытуемой воды, отмеренной цилиндром в коническую колбу, приливают 2-3 капли фенолфталеина. Если окраска не появилась, то в колбу добавляют 2-3 капли метилоранжа и титруют 0,1 N - раствором соляной кислоты до перехода окраски из соломенно-желтой в оранжевую. Если же окраска по ф/ф появилась, то раствор надо оттитровать соляной кислотой 0,1 N до исчезновения окраски и затем уже ввести индикатор метилоранж. Суммарное количество кислоты, пошедшее на титрование, и есть общая щелочность воды. Титрование нужно вести на белом фоне. Общую щелочность воды находят по формуле 4:
|
(4) |
где: V – количество кислоты, израсходованной на титрование 50 мл воды, мл;
N – нормальность раствора кислоты.
Результаты определения Що представлены в таблице 1.
Таблица 1 – Результаты определения общей щелочности исходной воды
|
V, мл |
Що, мг-экв/л |
|
|
1 |
1,5 |
3 |
0,1 |
0,01 |
2 |
1,5 |
3 |
0,1 |
0,01 |
3 |
1,4 |
2,8 |
0,2 |
0,04 |
Σ |
4,4 |
8,8 |
0,4 |
0,06 |
Σ/3 |
1,47 |
2,9 |
0,13 |
0,02 |

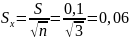

 мг-экв/л.
мг-экв/л.

 ,
мг/л,
,
мг/л, ,
мг/л,
,
мг/л, мг-экв/л,
мг-экв/л, ,
мг-экв/л
,
мг-экв/л ,
мг-экв/л
,
мг-экв/л