
Хід уроку
І. ОРГАНІЗАЦІЙНИЙ ЕТАП
Привітання, перевірка готовності до уроку. Поділ класу на активні центри (учням пропонується витягнути з коробки “смайлик”, в залежності від кольору вони займають своє місце у класі).
ІІ. МОТИВАЦІЯ УЧБОВОЇ ДІЯЛЬНОСТІ
Бесіда:
Яка речовина є найбільш поширеною на Землі?
Які властивості вона має?
Чи часто ми можемо зустріти її у чистому вигляді, чому?
Демонстрація слайдів або фотоматеріалів “Незвичні властивості води”:





Чим на ваш погляд можна пояснити ці унікальні характеристики?
ІІІ. АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Бесіда-змагання груп.
Які типи зв'язку ви знаєте?
За рахунок чого утворюється зв'язок?
Як утворюється ковалентний зв'язок?
В чому особливість ковалентного полярного зв'язку?
ІV. СПРИЙНЯТТЯ І ОСМИСЛЕННЯ НОВОГО МАТЕРІАЛУ
Кожен з активних центрів класу отримує завдання та літературу, щодо роботи. Їх задачею є презентувати повідомлення з розглянутого питання використовуючи запропоновані слайди, макети яких вони отримують разом з питанням.
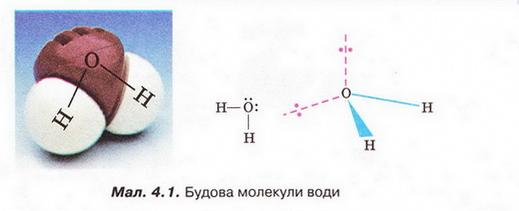
І — Будова молекули води (можливий варіант доповіді):
Вода як розчинник має непересічне значення. Здатність води розчиняти найрізноманітніші речовини та її інші унікальні властивості спричинені насамперед хімічним складом і будовою молекули цієї сполуки. Тож розгляньмо особливості будови молекули води. Вам добре відомо, що до її складу входять два атоми Гідрогену й один атом Оксигену. Ви знаєте, що електронегативність Оксигену значно більша за електронегативність Гідрогену. Тому утворені за рахунок спільних електронних пар зв'язки О-Н у молекулі води ковалентні полярні. Вони розміщені під кутом 104,5°, і це спричинює асиметричність структури і виникнення диполя. Що таке диполь і за яких умов молекула є диполем?
Демонстрація досліду:
За допомогою простого досліду можна пересвідчитись у тому, що молекули води полярні: тонка водяна цівка притягується до пластмасового корпусу ручки чи ебонітової палички, наелектризованих тертям.
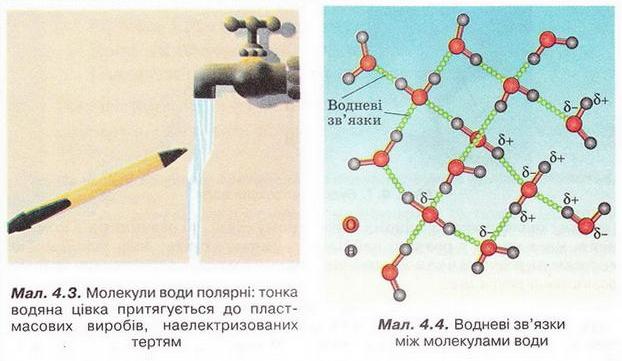
Під впливом диполів води на поверхні речовин, занурених у неї, міжатомні й міжмолекулярні сили слабшають у 80 разів. Така висока діелектрична проникність з усіх відомих речовин властива тільки воді. Цим пояснюють її здатність бути універсальним розчинником.
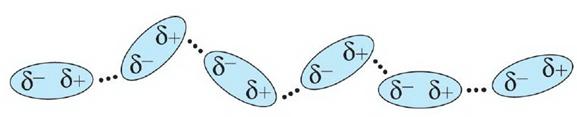
ІІ — Утворення водневого зв'язку його вплив на властивості води (можливий варіант доповіді):
Асиметричність розподілу електричних зарядів у молекулах води є причиною утворення між ними так званих водневих зв'язків. З наявністю цих зв'язків пов'язані аномально високі (порівняно з леткими сполуками інших елементів VIA групи періодичної системи) температури кипіння і плавлення води.

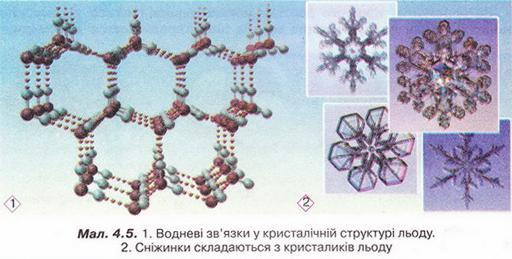
Завдяки водневим зв'язкам між молекулами вода виявляє унікальні властивості. Ці міжмолекулярні зв'язки стабілізують нещільну кристалічну структуру льоду. Через особливості будови кристалів льоду його густина менша за густину води у рідкому агрегатному стані. Ця властивість запобігає глюмерзанню водойм.
ІІІ — Розчин, його склад (можливий варіант доповіді):
Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Чи не найпоширеніші розчинники — рідини.
