
Задача №19
Определить
направление реакции, приведенной
в табл. 2, при температуре Т
К (табл. 6) и общем давлении р
Па, если
число молей неравновесной смеси
![]() ,
,
![]() (исходные вещества),
(исходные вещества),
![]() ,
,
![]() (продукты реакции) даны в табл. 17. Значение
константы равновесия при температуре
Т
взять из задачи №17.
(продукты реакции) даны в табл. 17. Значение
константы равновесия при температуре
Т
взять из задачи №17.
Таблица 17
Вариант |
|
|
|
|
р·10–6, Па |
1 |
0,5 |
0,2 |
0,3 |
– |
9,73 |
2 |
0,5 |
0,1 |
0,5 |
0,1 |
9,74 |
3 |
0,5 |
– |
0,5 |
– |
9,75 |
4 |
0,25 |
0,25 |
0,25 |
0,25 |
9,73 |
5 |
0,3 |
0,2 |
0,2 |
0,3 |
9,73 |
6 |
0,25 |
0,35 |
0,15 |
0,25 |
9,73 |
7 |
0,6 |
– |
0,2 |
0,2 |
9,74 |
8 |
0,25 |
0,4 |
0,25 |
0,1 |
9,77 |
9 |
0,35 |
0,3 |
0,25 |
0,1 |
9,78 |
10 |
0,1 |
0,6 |
0,15 |
0,15 |
9,73 |
11 |
0,325 |
– |
0,325 |
0,35 |
9,77 |
12 |
0,4 |
– |
0,3 |
0,3 |
9,77 |
13 |
0,3 |
0,3 |
0,4 |
– |
9,78 |
14 |
015 |
0,15 |
0,7 |
– |
9,79 |
15 |
0,15 |
0,15 |
0,35 |
0,35 |
9,76 |
16 |
0,25 |
0,25 |
0,25 |
0,25 |
9,76 |
17 |
0,5 |
– |
0,15 |
0,35 |
9,78 |
18 |
0,35 |
0,5 |
0,15 |
– |
9,79 |
19 |
0,5 |
0,4 |
0,1 |
– |
9,73 |
20 |
0,3 |
0,2 |
0,2 |
0,3 |
9,73 |
21 |
0,2 |
0,2 |
0,6 |
– |
9,79 |
22 |
0,55 |
– |
0,15 |
0,3 |
9,74 |
23 |
0,35 |
0,55 |
0,1 |
– |
9,75 |
24 |
0,4 |
– |
0,4 |
0,2 |
9,73 |
25 |
0,25 |
0,4 |
0,25 |
0,1 |
9,71 |
26 |
0,8 |
0,15 |
0,15 |
- |
9,77 |
27 |
0,3 |
– |
0,3 |
0,4 |
9,75 |
28 |
0,1 |
0,6 |
0,15 |
0,15 |
9,78 |
29 |
0,25 |
– |
0,25 |
0,5 |
9,77 |
30 |
0,15 |
0,15 |
0,35 |
0,35 |
9,76 |
Решение:
Решение
задачи рассмотрим на примере реакции
образования аммиака
.
Определим
направление данной реакции при
температуре Т
= 800 К и общем давлении р
= 9,73·106
Па, если число молей компонентов реакции
в исходной неравновесной смеси составило
= 0,5;
![]() = 0,3;
= 0,3;
![]() = 0,2. Значение константы равновесия
= 0,2. Значение константы равновесия
![]() (см. задачу № 17).
(см. задачу № 17).
Установим
знак величины
![]() .
Воспользуемся
уравнением изотермы Вант–Гоффа:
.
Воспользуемся
уравнением изотермы Вант–Гоффа:
![]() ,
(63),
,
(63),
где
![]() – величина, рассчитываемая по той же
формуле, что и
– величина, рассчитываемая по той же
формуле, что и
![]() ,
но для неравновесных условий, как
отношение неравновесных парциальных
давлений компонентов реакции (
,
но для неравновесных условий, как
отношение неравновесных парциальных
давлений компонентов реакции (![]() )
)
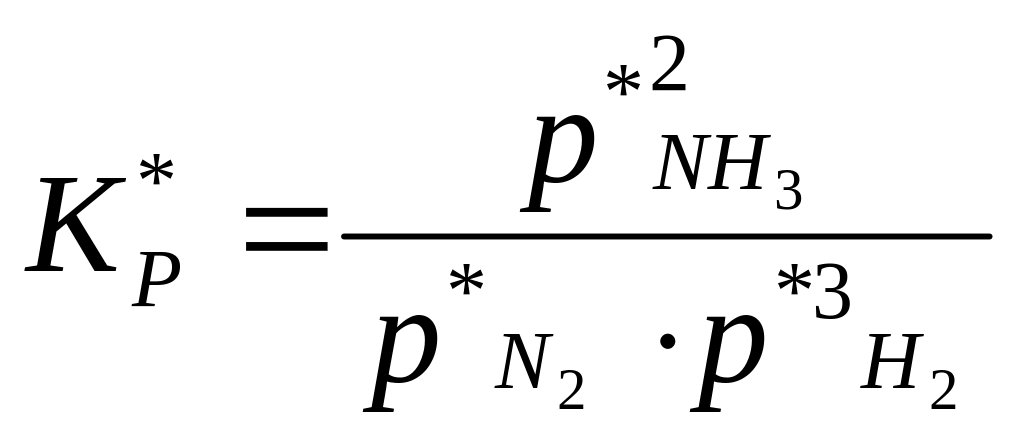 .
.
 .
.
При анализе уравнения изотермы Вант–Гоффа следует рассмотреть три случая:
1)
Если
>
,
то
![]() > 0, т.е. реакция идет в обратном
направлении в сторону образования
исходных веществ.
> 0, т.е. реакция идет в обратном
направлении в сторону образования
исходных веществ.
2) Если < , то < 0, т.е. реакция идет самопроизвольно в прямом направлении в сторону образования продуктов реакции.
3) Если = , то = 0, т.е. система находится в равновесии.
Рассчитаем
величину
через
![]() – константу, выраженную через мольные
доли компонентов в неравновесной
исходной смеси.
– константу, выраженную через мольные
доли компонентов в неравновесной
исходной смеси.
 .
.
Для
этого рассчитаем величины мольных долей
компонентов неравновесной смеси
![]() с использованием формулы
с использованием формулы
![]() .
.
Общее число молей неравновесной смеси
![]() .
.
Мольные доли компонентов в данном случае:
![]() ;
;
![]() ;
;
![]()
численно равны числу молей этих компонентов в системе.
![]() .
.
Так
как
<
,
то выполняется условие (2), следовательно,
реакция будет протекать самопроизвольно
в прямом направлении. Подтвердим
полученные данные расчетом
![]() :
:
![]() Дж/моль.
Дж/моль.
