
Тема 3. Расчет характеристических термодинамических функций
Задача №9
Определите абсолютную энтропию ST 1 моль вещества, указанного в таблице 10, при температуре Т К (табл. 6), если известны значения температур плавления и кипения этого вещества. Теплоемкости веществ в различных агрегатных состояниях возьмите из справочника.
Теплоту испарения возьмите из расчетов задачи №5.
Таблица 10
Вариант |
Вещество |
ТПЛ, К |
ТКИП, К |
1 |
|
244 |
374 |
2 |
|
183 |
387 |
3 |
|
257 |
471 |
4 |
|
291 |
563 |
5 |
|
181 |
280 |
6 |
|
178 |
329 |
7 |
|
280 |
354 |
8 |
|
189 |
350 |
9 |
|
147 |
370 |
10 |
|
158 |
351 |
11 |
|
194 |
411 |
12 |
|
281 |
374 |
13 |
|
209 |
334 |
14 |
|
267 |
457 |
15 |
|
157 |
308 |
16 |
|
231 |
389 |
Продолжение таблицы 10
Вариант |
Вещество |
ТПЛ, К |
ТКИП, К |
17 |
|
244 |
450 |
18 |
|
178 |
384 |
19 |
|
216 |
399 |
20 |
|
281 |
374 |
21 |
бутанол |
193 |
391 |
22 |
|
174 |
297 |
23 |
|
143 |
309 |
24 |
|
290 |
391 |
25 |
|
279 |
484 |
26 |
|
228 |
405 |
27 |
|
225 |
412 |
28 |
|
286 |
398 |
29 |
|
285 |
374 |
30 |
|
279 |
353 |
Решение:
Определим абсолютную энтропию 1 моль воды при температуре минус 700 С.
Абсолютное значение энтропии позволяет определить третье начало термодинамики или теорема Нернста: при абсолютном нуле энтропия правильного кристалла любого чистого вещества равна нулю (эту формулировку теоремы Нернста предложил М.Планк).
S0 = 0 при Т = 0.
Абсолютную энтропию вещества при температуре Т рассчитывают, используя постулат Планка, а также значения теплоемкостей, температур фазовых переходов и теплот фазовых переходов в интервале от 0 К до Т. На практике для расчета абсолютной энтропии при температуре Т используют справочные данные об абсолютных энтропиях веществ при 298 К. При расчете вносится поправка, учитывающая изменение энтропии вещества в интервале от 298 К до Т.
![]() .
.
По
условию задачи необходимо определить
энтропию при температуре минус 700
С, т.е. при
203 К, следовательно, к значению
![]() необходимо прибавить
изменение энтропии в интервале температур
от 298 до 203 К.
необходимо прибавить
изменение энтропии в интервале температур
от 298 до 203 К.
В заданном интервале температур вода претерпевает фазовое превращение – плавление при 273 К. Расчет энтропии проводится по аддитивной схеме:
![]() .
(31)
.
(31)
В справочнике найдем абсолютную энтропию воды при 298 К.
![]() =
69,95 Дж/(моль∙К).
=
69,95 Дж/(моль∙К).
Изменение энтропии при нагревании и плавлении определим по формулам:
 ,
(32)
,
(32)
 ,
(33)
,
(33)
 ,
(34)
,
(34)
где n – число молей вещества; по условию задачи n = 1.
Теплоту кристаллизации воды найдем по справочнику:
Hоплавления = 6000 Дж/моль. Hокрист. = - Hоплавления = -6000 Дж/моль.
Примечание:
теплоту
плавления для органических веществ
рассчитайте по формуле
![]() = 54,4 ± 12,6 Дж/(моль·К).
= 54,4 ± 12,6 Дж/(моль·К).
![]() -21,98 Дж/К.
-21,98 Дж/К.
Изменение температуры жидкости равно 25 градусов. Температурный интервал невелик, и можно пренебречь зависимостью теплоемкости жидкой воды от температуры. Для расчетов воспользуемся средним значением теплоемкости; по справочнику
![]() =
75,3 Дж/(моль∙К).
=
75,3 Дж/(моль∙К).
Расчет в этом случае проведем по формуле:
![]() =
-6,59 Дж/К.
=
-6,59 Дж/К.
Для льда разность температур составляет 70 градусов. Учтем зависимость теплоемкости от температуры (коэффициенты уравнения возьмем из справочника):
![]() =
4,41 + 109,5·10–3Т
+ 46,47·10–6Т2
Дж/(моль∙К).
=
4,41 + 109,5·10–3Т
+ 46,47·10–6Т2
Дж/(моль∙К).
![]() =
=
=![]()
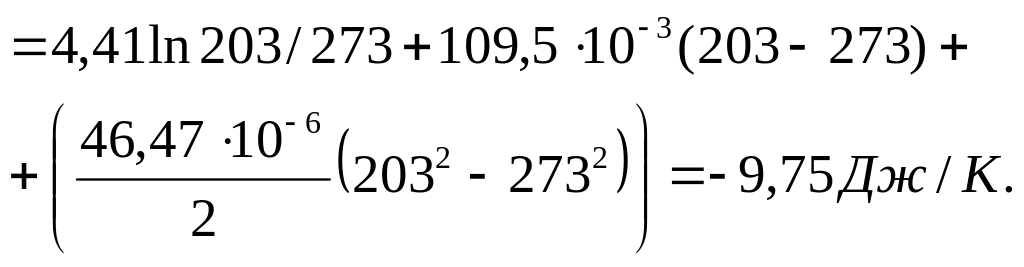
Рассчитаем абсолютную энтропию воды при –700 С (31):
![]() =
69,95 – 21,98 – 6,59 – 9,75 = 31,63 Дж/К.
=
69,95 – 21,98 – 6,59 – 9,75 = 31,63 Дж/К.
