
- •Общаяя химия
- •Четыре варианта влияния на температуры самопроизвольный процесс:
- •Теория активных соударений
- •Катализ
- •Для не электролитов
- •Теория аррениуса
- •Буферные растворы
- •Сн3cooh / ch3cooNa; и добавили hCl
- •Сн3cooh / ch3cooNa; и добавили koh
- •CrCl3 6h2o
- •К омплексные соединения
- •Глицерат меди
- •Классификация электродов по природе реакции
- •30,5 КДж/моль
- •Мицелла
Буферные растворы
Буферные растворы – это смесь кислоты и сопряженного основания рН не изменяется при изменении или добавлении сильной кислоты или основания.
Буферы бывают:
H2CO3 + NaOH = NaHCO3 (Бикорбанатный буфер);
NaH2PO4 = Na2HPO4 (Фосфотный буфер);
Pt – COOH = Pt – COONa (Белковый буфер);
H | Hb / -Hb- (Гемоглобиный буфер Hb);
H | HbO2 / HbO2- (Оксигемоглобиновый буфер);
СН3COOH / CH3COONa (Ацетатный буфер);
NH4OH / NH4Cl (Аммиачный буфер).
AH =H+ + A-
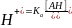
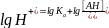

Уравнение Гендерсона-Хасельбаха
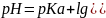
1-го рода – слабая кислота и её соль с сильным основанием
СН3COOH / CH3COONa;

2-го рода – слабое основание и его соль с сильная кислота
NH4OH
/ NH4Cl;
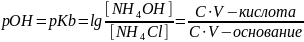

3-го рода – механизм действия буферного раствора одинаков. заключается в том, что если к буферу добавить не большое количество кислоты или основание то рН не изменится.
Сн3cooh / ch3cooNa; и добавили hCl
СН3СООNa + HCl = CH3COOH + NaCl
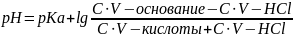
Сн3cooh / ch3cooNa; и добавили koh
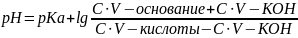
pH = 14 – pOH; pKa + pKb = 14
Буферная ёмкость – это расчётная величина которая равна руслу молярных масс эквивалентна сильной кислоты или основания, которого надо добавить в 1 литр буферного раствора чтобы рН изменился на 1
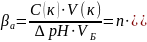
Буферные системы организма
рН крови – 7,4 (7,35 – 7,45)
Н+ |
100 |
45 |
40 |
36 |
16 |
зР |
7,0 |
7,35 |
7,4 |
7,45 |
7,8 |
Углекислый газ 13 моль за сутки более одного литра концентрирует соляной кислоты. другие кислоты 70 ммоль: серная, кетоновая, фосфоорганические кислоты.
Бикорбанарный буфер
СO2 + H2O = H2CO3 = H+ + HCO3-
+lg20=6,1+1,3=7,4
pKa = 6,1
Гемоглабиновый буфер
HH = H+ + Hb- pK = 8,25
HHbO2 = H+ + HbO2- pK = 6,6
CO2 + H2O2 = H2CO3 = H + HCO3
Лёгкие




Эритроцит
Н2О

Плазма
СО2
Ткань
CO2+H20=H2CO3
HCl
HHbO2=HCH+O2
O2
Cl2
П




Эритроцит
О2+HHb=HHbO2
HCO3-
Cl-
H2CO3
CO2
H2O
Cl-
O2
HCO3
очки
Показатели кислотно-щелочного равновесия
pH = 7,35 – 7,45
концентрация ионов: 36 -45 нмоль/л,
рСО2: 35 – 45 мм.рт.ст,
актуальный бикорбанат у взрослого: 21 – 22 – 28 ммоль/л,
актуальный бикорбанат у ребёнка: 19 -24 ммоль/л,
актуальный бикорбанат у новорождённого: 17 – 24 ммоль/л,
стандартный бикорбанат: 22 – 26 ммоль/л.
Избыток буферных оснований ( – 1 до + 2)
Новорождёные (– 10 до – 2)
Груднички ( – 7 до – 1), Ребёнок ( – 4 до + 1).
Обучающие задачи и эталоны их решения
Задача 1:
При 25°С давление насыщенного пара воды составляет 3,166 кПа (23,75 мм.рт.ст.).Найти при той же температуре давление насыщенного пара над 5% водным раствором кароамида (мочевины (NH2)2CO)
Решение:
1 – Кратко записать условие задачи
Р° = 3,166 кПа
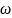 =
25%
=
25%
T = 250C
Найти: Р – ?
2 – Записать выражение 1-го закона Рауля исходя из молярной доли растворителя (воды)
Р = Р0Х(растворителя)
3 – вычислить молярную долю (NH2)2CO
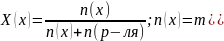
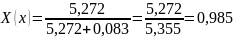
4 – вычислить давление насыщенного пара над раствором
Х(х)
= 3,166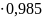 = 3,119 кПа ( или 23,21 мм.рт.ст.)
= 3,119 кПа ( или 23,21 мм.рт.ст.)
Задача 2:
55,16 г сахарозы растворено в 316,3 г воды. Рассчитать температуру кипения этого раствора.
Температура кипения раствора
Решение:
1 – Кратко записать условие задачи
m(сахара) = 55,16 г.
m (Н2О) = 316,3 г.
Ткип(Н2О) = 237,15 + 100 = 337,15 К
R = 8,314 Дж/К моль
М (сахара) = 348 г/моль
М (Н2О) = 18 г/моль
Ткип (раствора) – ?
2 – Вычислить моляльную концентрацию раствора сахарозы
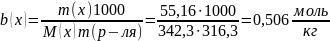
3 – Вычислить повышение температуры кипения раствора сахарозы
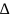 Тк
= Кэb(x)
= 0,512
0,506
= 0,26К
Тк
= Кэb(x)
= 0,512
0,506
= 0,26К
4 – определить температуру кипения раствора сахарозы
Тк (раствора) = Тк (Н2О) + Т = 337,15 + 0,26 = 337,41 К
Задача 3:
Вычислить осмотическое, давление раствора с массовое долей глюкозы 1% (плотность раствора принять равной 1г/см3). Будет ли данный раствор изотоничен для крови? R = 0,082 л атм /К моль
Решения:
1 – Кратко записать условие задачи, учитывая, что температура тела человека 37°С
(C6Н12О6) = 1%
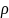 =
1 г/см3
=
1 г/см3
R = 0,082 л атм /К моль
π – ?
2 – Записать математическое выражение закона Вант-Гоффа
π
= С(х)RT;
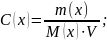
3 – Найти объем раствора

4 – Найти осмотическое давление
π
=
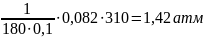
5. Сравнить осмотическое давление раствора глюкозы с осмотическим давлением крови(7,7 атм)
π (раствора) = 1,72 атм
π (крови) = 7,7 атм
1,72 атм < 7,7 атм
Данный раствор с массовой долей глюкозы 1% гипотоничен по отношению к крови.
Задача 4:
Рассчитать значение рН, для раствора хлорида аммония с концентрацией 0,1 моль/л
Решение:
1 – Хлорид аммония гидролизуется по катиону, поэтому реакция среды кислая
NH4+ + H2O = NH3 + H3O
NH4+ – слабая кислота
2 – рН соли NH4Cl, образованной слабым основанием NH3 и сильной кислотой HCl, рассчитывает, по формуле
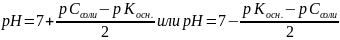
3 – Значения Кдисс и рКдисс находят в справрчнике:
Кдисс = 1,79 10-5, рКдисс = 4,74
4 – Ссоли = 10= 10-1
рС = -lgCсоли = -lg10-1
pCсоли = 1
5 – Подставляет значения рК и рС в формулу
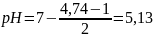
Задача 5:
Найти рН раствора соляной кислоты с концентрацией 0,05 моль/см3-
Решение:
HCl = Cl- + H+
если учитывать, что соляная кислота практически
полностью диссоциирована то
[H+] = [HCl] = 0,05 моль/дм3
[H+] = 0,05 = 5 10-2 моль/дм3
рН = -lg[H+] = -lg5 10-2 = -lg5 + lg10-2 = -0,699 + 2 = 1,3010 = 1,3
Задача 6:
Определите рН буферного раствора приготовленного из 100 см3 раствора с концентрацией СН3СООН 0,1 моль/дм3 и 200 см3 раствора с концентрацией 0,2 моль/дм3. Как изменится рН этого раствора при добавлении к нему 5 см3 раствора с концентрацией NaOH 0,1 моль/дм3 и при разбавлении его в 10 раз? рКа (СН3СООН) = 4,75
Решение:
рН буферного раствора определяется по уравнению Гендельсона-Хасельбаха
Согласно протолитической теории Бренстеда-Лоури равновесие в данной буферной системе можно выразить в виде уравнения
СН3СООН + Н2О = СН3СОО- + Н3О+
[СН3СОО-] = n(CH3COONa) = C(CH3COONa) V(CH3COONa)
[СН3СООH] = n(CH3COOH) = C(CH3COOH) V(CH3COOH)
Подставив в уравнение Гендельсона-Хасельбаха для расчета рН
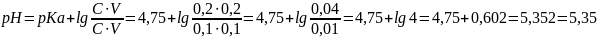
При добавлении к буферному раствору щелочи то последней взаимодействует уксусная кислота по уравнению
СH3COOH + NaOH = CH3COONa + H2O
При этом концентрация кислоты уменьшается, а концентрация соли соответственно увеличивается эквивалентно добавленной щелочи
n(NaOH) = C(NaOH) V(NaOH)

Величина рН при добавлении изменилась на (5,37 – 5,35 = 0,02) т.е. незначительно
При добавлении буферного раствора водой в 10 раз концентрация каждого из компонента умеьшется в 10 раз
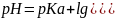
Отсюда видно, что при разбавлении водой, величина рН буферного раствора не изменяется. Однако с разбавлением слабого электролита, согласно закону Освальда увеличивается степень его диссоциации, а разбавлении соли влечёт за собой изменение гидролиза. Однако эти изменения незначительны.
Задача 7:
К 100 см3 крови измерения рН от 7,36 до 7,00 добавили 36 см3 раствора HCl с концентрацией 0,05 моль/дм3. Рассчитайте буферную ёмкость крови по кислоте?
Решение:
Буферная ёмкость крови по кислоте определяется по формуле:
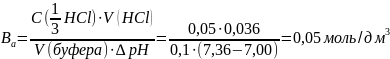
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
определенные химические соединения, образованные сочетанием отдельных комплексов и представляющие собой сложные ионы или молекулы, способные к существованию как в кристаллическом, так и в равновесном состоянии;
CuSO4 + 4NH3 = [Cu(NH3)4]SO4; PtCl4 + KCl = K2[PtCl6].
Лиганды – ионы или молекулы , непосредственно связанные с центральным атомом.
Центральный атом – (комплексообразователь) атом, стремящийся под действием сил главной и побочной валентности окружить слои ионами или молекулами. В роли комплексообразователей чаще всего выступают катионы металлов;
Д
ентатность (координационная ёмкость) – число координационных мест, занимаемых лигандами около комплексообразователя. например, анионы СО32-, SO42- являются бидентатными. Лигандами типа Н2О, NH3, ионов галогенов и цианид-иона всегда монодентатны;
Теория Вернера:
1-е положение – атом кроме своей обычной валентности может проявлять дополнительные валентности. Обозначается пунктиром или стрелочкой только при обратном комплексном соединении,
2-е положение – каждый компонент состоит из центрального атома металла или неметалла с которым получаются связи с лигандами,
3-е положение – каждый комплекс характеризует координационное числа – общее число связей, образуемых комплексообразователем с лигандами.
С центральным атомом, лигандами образуют внутреннюю сферу компонента – представляют комплексообразователь и лиганды. Связь между ними ковалентная, образованная по обменному и донорно-акцепторному механизму (берётся в [ ]).
4-е положение – внутренняя сфера может либо нейтральной или положительно или отрицательно заряжена. Внешняя сфера – находится за пределами внутренней сферы комплексного соединения. Ионы, находятся во внешней сфере, связаны с комплексным ионом, силами электростатического взаимодействия и в растворах легко отщепляются подобно ионам сильных электролитов.
K 4[Fe(CN)6]; [Pt(NH3)6]Cl4; [Pt(NH3)2Cl2]
внешняя сфера внутренняя сфера только внутренняя
Типы и номенклатура (ИЮПАК)
Анионного типа
К2[Fe(CN)5NH3] = 3K+ + [Fe2+(CN)55- NH3]3-
координационное число = 6
Пентацианоамино феррат II Калия
K[Co(NH3)2(NO2)4]-1
K[Co(NH3)(NO2)5]-2
K[Co(NO2)6]-3
Катионного типа
[Zn(NH3)4]Cl2 = 2Cl- + [Zn+(NH3)4]2+
координационное число = 4
Тетраамина цинк I хлорид
[Co(NH3)4(NO2)2]Cl
координационное число = 6
Динитротетраамино кобальт III хлорид
[Pt(NH3)4Br2]Cl2
координационное число = 5
Дибромотетраамина платина IV хлорид
[Co(NH3)6]3+Cl3
[Co(NH3)5NO2]2+Cl2
[Co(NH3)4 (NO2)2]+Cl
Нейтрального типа
[Pt2-(NH3)2Cl2]
координационное число = 3
дихлородиамино платина III
[Pt(NH3)4Cl2]
координационное число = 5
дихлоротетраамино платина II
[Co(NH3)3 (NO2)3]
Изомерия
Гидратна (Сальваторная) изомерия – различные распределения молекулы воды между внутренней и внешней сферы.
