
- •1. Введение
- •2. Основные термины и определения
- •3. Роль регуляторных механизмов в поддержании клеточного гомеостаза
- •4. Типы регуляции
- •5. Практическое использование знаний об основах регуляции метаболизма у микроорганизмов
- •1. Способ регуляции метаболических процессов, основанный на избирательном синтезе ферментов
- •2. Регуляция репликации днк
- •3. Регуляция процесса транскрипции. Механизмы индукции и репрессии
- •4. Другие механизмы регуляции транскрипции у микроорганизмов
- •1. Избирательный синтез ферментов за счет регуляции процесса трансляции у микроорганизмов
- •2. Биосинтез и сборка компонентов аппарата трансляции
- •3. Регуляция функционирования аппарата трансляции
- •4. Способы регуляции биосинтеза и круговорота белков у микроорганизмов путем посттрансляционной модификации и избирательного протеолиза
- •1. Способ регуляции метаболических процессов у микроорганизмов, основанный на изменении активности ферментов
- •2. Простые и регуляторные ферменты
- •3. Аллостерические ферменты и эффекторы
- •4. Гомотропная и гетеротропная кооперативность
- •5. Обратимая ковалентная модификация
- •1. Специфические механизмы регуляции активности ферментов у микроорганизмов. Регуляция путей биосинтеза и промежуточного обмена
- •2. Роль энергетического заряда в регуляции клеточного метаболизма
- •3. Регуляторные эффекты Пастера и Крэбтри
- •4. Регуляция метаболической активности за счёт компартментализации ферментов и их взаимодействия с клеточными мембранами
- •1. Пассивная проницаемость и транспортные функции цитоплазматической мембраны бактерий
- •2. Энергетика транспортных процессов у микроорганизмов
- •3. Организация и регуляция транспортных процессов на уровне биосинтеза. Сборка и функционирование компонентов транспортных систем
- •1. Общая характеристика процесса клеточного деления
- •2. Накопление критической клеточной массы и репликация днк генома
- •3. Построение клеточной оболочки и перегородки
- •4. Взаимоотношение репликации днк и сборки клеточной перегородки
- •1. Скорость метаболизма в процессе клеточного деления
- •2. Выявление «узких мест» в метаболизме микробной клетки
- •3. Связь скорости роста микроорганизмов с биосинтезом стабильных форм рнк
- •4. Взаимосвязь регуляторных механизмов и их реализация в развивающихся микробных клетках
- •5. Регуляция межклеточных взаимодействий
- •1. Общая характеристика методологических подходов к решению научных проблем регуляции метаболизма микробных клеток
- •2. Классификация методов изучения регуляции метаболической активности
- •3. Методические особенности изучения скорости роста и активности транспортных систем у микроорганизмов
- •4. Методы изучения регуляции клеточного метаболизма с использованием мутантных микроорганизмов
- •Практика
- •Вводная часть
- •Основные термины и определения
- •1 Подготовка бактериальных клеток к анализу
- •1.1 Интактные клетки
- •1.1.1 Растущие клетки
- •1.1.2 Покоящиеся клетки
- •1.1.3 Голодающие покоящиеся клетки
- •1.2 Проницаемость клеток
- •1.2.1 Обработка растворителями
- •1.2.2 Обработка хелатообразующими агентами
- •1.3 Препараты дезинтегрированных клеток
- •1.3.1 Разрушение клеток под действием осмотических сил
- •1.3.2 Дезинтеграция
- •2 Изучение метаболической активности микроорганизмов. Общая характеристика условий эксперимента
3. Построение клеточной оболочки и перегородки
Процесс образования новой клеточной оболочки (мембраны и клеточной стенки) включает две основные стадии:
пролиферация поверхностных клеточных структур, т.е. накопление в них нового материала в динамике клеточного цикла;
сегрегация поверхностных структур клетки, т.е. включение нового материала в предшествующие структуры по местам локализации соответствующих центров (сайтов) включения.
Включение белков в мембраны бактерий следует сложной кинетике, свидетельствующей о накоплении предварительно образованных белков в цитоплазме в период подготовки клеточного деления и быстрой их мобилизации в процессе деления. В период деления возрастает активность некоторых литических ферментов (в частности, муреингидролаз), участвующих в образовании брешей в предшествующем каркасе клеточной стенки: необходимых для включения новых ее фрагментов. Таким образом, регуляция активности этих ферментов осуществляется путем перевода их в скрытое, латентное состояние с последующей мобилизацией в определенный момент времени.
Консервативный механизм сегрегации предусматривает включение новых фрагментов на одном из полюсов клетки, при этом поверхностные слои всех дочерних клеток состоят из новообразованного материала. Такой способ сегрегации реализуется в процессе почкования, характерного для некоторых микроорганизмов, но не при обычном клеточном делении.
Полуконсервативный механизм сегрегации предполагает локализацию сайтов включения новых фрагментов в экваториальной зоне клетки. В результате появляются дочерние клетки с полностью новообразованными поверхностными структурами, но лишь при второй генерации после начала наблюдения.
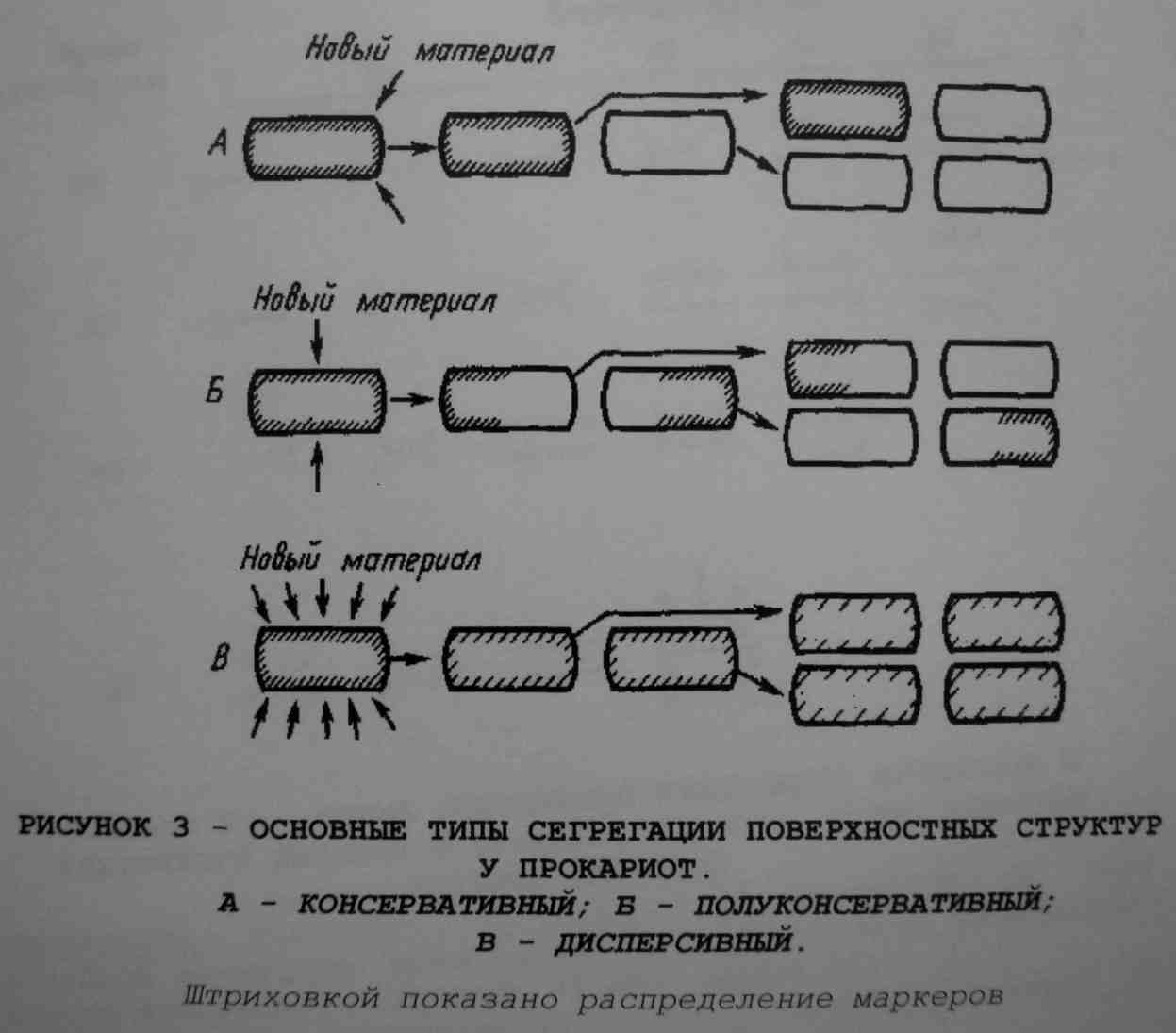 Дисперсивный
механизм сегрегации
предусматривает включение новых
фрагментов на множестве сайтов по всей
поверхности клетки, что приводит к
постепенному «разбавлению» старых
структур новыми и равномерному
распределению маркеров на поверхности
дочерних клеток.
Дисперсивный
механизм сегрегации
предусматривает включение новых
фрагментов на множестве сайтов по всей
поверхности клетки, что приводит к
постепенному «разбавлению» старых
структур новыми и равномерному
распределению маркеров на поверхности
дочерних клеток.
Процесс построения новой клеточной перегородки завершает клеточный цикл. В раскрытии механизмов регуляции этого процесса важный вклад внесло изучение специфических мутантов, из которых наибольшую ценность представляют «условные» мутанты. У мутантов данного типа процесс протекает нормально при обычных физиологических условиях (пермессивных условиях), а при непермессивных условиях (повышенная температура, действие радиации) процесс подавляется. В частности, для изучения регуляции процесса построения клеточной перегородки использовались мутанты Е. coli и Вас subtilis, образующие «миниклетки» (min-мутанты). Существование min-мутаций позволило определить, что сайт, ответственный за образование перегородки и локализующийся в процессе деления в экваториальной зоне клетки, сохраняется на полюсах дочерних клеток при последующем их расхождении. В норме сайты построения перегородки, локализованные на полюсах клетки, выключаются (блокируются) и могут функционировать наряду с экваториальными сайтами лишь у min -мутантов. Это обстоятельство позволяет постулировать существование определенного компонента - активатора сборки клеточной перегородки. На протяжении клеточного цикла образуется ограниченное количество («квант») этого активатора, достаточное для функционирования лишь одного сайта (при этом активатор полностью расходуется). В нормальных клетках количество «квантов» активатора и количество функционирующих сайтов построения перегородки совпадает, а у min-мутантов количество сайтов превышает количество «квантов» активатора.
