
- •1. Введение
- •2. Основные термины и определения
- •3. Роль регуляторных механизмов в поддержании клеточного гомеостаза
- •4. Типы регуляции
- •5. Практическое использование знаний об основах регуляции метаболизма у микроорганизмов
- •1. Способ регуляции метаболических процессов, основанный на избирательном синтезе ферментов
- •2. Регуляция репликации днк
- •3. Регуляция процесса транскрипции. Механизмы индукции и репрессии
- •4. Другие механизмы регуляции транскрипции у микроорганизмов
- •1. Избирательный синтез ферментов за счет регуляции процесса трансляции у микроорганизмов
- •2. Биосинтез и сборка компонентов аппарата трансляции
- •3. Регуляция функционирования аппарата трансляции
- •4. Способы регуляции биосинтеза и круговорота белков у микроорганизмов путем посттрансляционной модификации и избирательного протеолиза
- •1. Способ регуляции метаболических процессов у микроорганизмов, основанный на изменении активности ферментов
- •2. Простые и регуляторные ферменты
- •3. Аллостерические ферменты и эффекторы
- •4. Гомотропная и гетеротропная кооперативность
- •5. Обратимая ковалентная модификация
- •1. Специфические механизмы регуляции активности ферментов у микроорганизмов. Регуляция путей биосинтеза и промежуточного обмена
- •2. Роль энергетического заряда в регуляции клеточного метаболизма
- •3. Регуляторные эффекты Пастера и Крэбтри
- •4. Регуляция метаболической активности за счёт компартментализации ферментов и их взаимодействия с клеточными мембранами
- •1. Пассивная проницаемость и транспортные функции цитоплазматической мембраны бактерий
- •2. Энергетика транспортных процессов у микроорганизмов
- •3. Организация и регуляция транспортных процессов на уровне биосинтеза. Сборка и функционирование компонентов транспортных систем
- •1. Общая характеристика процесса клеточного деления
- •2. Накопление критической клеточной массы и репликация днк генома
- •3. Построение клеточной оболочки и перегородки
- •4. Взаимоотношение репликации днк и сборки клеточной перегородки
- •1. Скорость метаболизма в процессе клеточного деления
- •2. Выявление «узких мест» в метаболизме микробной клетки
- •3. Связь скорости роста микроорганизмов с биосинтезом стабильных форм рнк
- •4. Взаимосвязь регуляторных механизмов и их реализация в развивающихся микробных клетках
- •5. Регуляция межклеточных взаимодействий
- •1. Общая характеристика методологических подходов к решению научных проблем регуляции метаболизма микробных клеток
- •2. Классификация методов изучения регуляции метаболической активности
- •3. Методические особенности изучения скорости роста и активности транспортных систем у микроорганизмов
- •4. Методы изучения регуляции клеточного метаболизма с использованием мутантных микроорганизмов
- •Практика
- •Вводная часть
- •Основные термины и определения
- •1 Подготовка бактериальных клеток к анализу
- •1.1 Интактные клетки
- •1.1.1 Растущие клетки
- •1.1.2 Покоящиеся клетки
- •1.1.3 Голодающие покоящиеся клетки
- •1.2 Проницаемость клеток
- •1.2.1 Обработка растворителями
- •1.2.2 Обработка хелатообразующими агентами
- •1.3 Препараты дезинтегрированных клеток
- •1.3.1 Разрушение клеток под действием осмотических сил
- •1.3.2 Дезинтеграция
- •2 Изучение метаболической активности микроорганизмов. Общая характеристика условий эксперимента
2. Роль энергетического заряда в регуляции клеточного метаболизма
Аденилаты выполняют в клетке важные регуляторные функции, представляя собой общие для катаболизма и анаболизма сигналы, обеспечивающие нужное соотношение между получением энергии и процессами биосинтеза. Внутриклеточное содержание AТФ, AДФ и AMФ (или, точнее, соотношение между этими тремя аденилатами) определяет скорость отдельных реакций, а тем самым и сложных процессов распада и синтеза.
В катаболических (энергетических) путях метаболизма (в промежуточном обмене) отрицательным эффектором для ферментов часто служит соединение, являющееся аккумулятором энергии (АТФ, пирофосфат и др.), тогда как другие компоненты аденилатной системы (АМФ, АДФ) могут выступать в качестве положительных эффекторов. Следовательно, активность рассмотренных ферментов определяется общим «энергетическим зарядом» клетки. Энергетический заряд клетки (потенциалом Аткинсона) вычисляется по формуле:
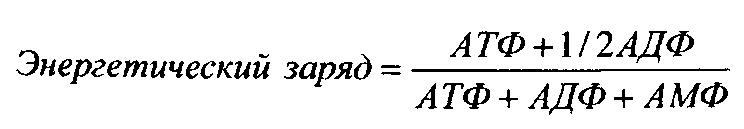
Его величина относительна, варьирует в пределах от 0 до 1 и характеризует молярную долю АТФ в общем балансе адениновых нуклеотидов, то есть служит мерой ее обеспеченности высокоэнергетическими соединениями в расчете на общее число «аденозиновых единиц» (аденилатов). Аллостерические ферменты активируются или ингибируются тем или иным аденилатом и именно это обеспечивает согласованную регуляцию всего метаболизма клетки. Если, например, энергетический заряд клетки возрастает, то активность катаболических ферментов снижается, а активность ферментов, участвующих в процессах синтеза, увеличивается. При уменьшении энергетического заряда наблюдается обратная картина. Энергетический заряд большинства живых клеток находится в пределах 0,75-0,90 (у растущих клеток равняется примерно 0,8). Клетки Е. coli погибают, когда значение этой величины меньше 0,5.
Адениннуклеотиды регулируют активность РНК-полимеразы, изменяя ее сродство к различным промоторам. Повышение содержания АДФ и АМФ и снижение эффективности процессов регенерации АТФ приводит к подавлению синтеза рРНК и других компонентов белоксинтезирующего аппарата, что представляется целесообразным в неблагоприятных для роста условиях. При высокой внутриклеточной концентрации АТФ и ГТФ, отражающей благоприятное энергетическое состояние клетки, синтез рРНК и других компонентов аппарата трансляции стимулируется. В результате регуляции процессов синтеза и распада АТФ в клетках живых организмов поддерживается стационарное энергетическое состояние.
3. Регуляторные эффекты Пастера и Крэбтри
 Регуляторный
«эффект Пастера»
- торможение гликолиза дыханием -
объясняется энергозависимой конкуренцией
за АДФ и фосфат между системами
фосфорилирования в дыхательной цепи
(окислительное
фосфорилирование) и
на уровне субстрата (субстратное
фосфорилирование).
Хорошо известно, что факультативно
анаэробные клетки, растущие в анаэробных
условиях, потребляют сравнительно очень
большие количества глюкозы (и образуют
большие количества продуктов брожения).
Если же ввести в среду кислород, то
клетки начнут немедленно его поглощать
и уровень потребления глюкозы резко
снизится. Это снижение скорости
гликолитического расщепления глюкозы
с началом дыхания и носит название
эффекта Пастера.
Регуляторный
«эффект Пастера»
- торможение гликолиза дыханием -
объясняется энергозависимой конкуренцией
за АДФ и фосфат между системами
фосфорилирования в дыхательной цепи
(окислительное
фосфорилирование) и
на уровне субстрата (субстратное
фосфорилирование).
Хорошо известно, что факультативно
анаэробные клетки, растущие в анаэробных
условиях, потребляют сравнительно очень
большие количества глюкозы (и образуют
большие количества продуктов брожения).
Если же ввести в среду кислород, то
клетки начнут немедленно его поглощать
и уровень потребления глюкозы резко
снизится. Это снижение скорости
гликолитического расщепления глюкозы
с началом дыхания и носит название
эффекта Пастера.
Эффект Пастера обусловлен подавлением активности фермента фосфофруктокиназы, который катализирует реакцию, лимитирующую общую скорость гликолиза, а именно фосфорилирование фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата. Фосфофруктокиназа представляет собой поливалентно регулируемый аллостерический фермент, который активируется АДФ и подавляется АТФ и цитратом. Знание аллостерических свойств фосфофруктокиназы позволяет сделать следующий вывод: если аэробно растущие дрожжевые клетки лишить кислорода и приостановить таким образом окислительное фосфорилирование, то в клетке снизится соотношение концентраций АТФ/АМФ, что приведет к повышению активности фермента и соответственно к ускорению реакции. Таким образом, снижение активности фосфофруктокиназы связано с ускорением образования АТФ и началом функционирования ЦТК при переходе к аэробному окислению глюкозы.
Регуляторный «эффект Кребтри» - торможение дыхания гликолизом - явление, обратное «эффекту Пастера», также объясняется энергозависимыми конкурентными взаимоотношениями систем окислительного и субстратного фосфорилирования за АДФ и фосфат. Одна из точек зрения состоит в том, что эффект Кребтри обусловлен активацией гликолиза высокими концентрациями глюкозы, что приводит к избытку продуктов гликолиза, которые, главным образом в виде ацетата, экскретируются в среду. Другая точка зрения заключается в том, что эффект Кребтри можно моделировать, применяя довольно низкие (миллимолярные) концентрации глюкозы, регистрируя при этом явление «дыхательного контроля» у бактерий. Обе точки зрения сходятся в одном - в основе механизма эффекта Кребтри лежит регуляторная способность факультативных анаэробов модулировать в широких пределах поток через гликолиз, чтобы компенсировать при необходимости нефункционирующий ЦТК усилением субстратного фосфорилирования и по той же причине иметь механизм сброса избытка продуктов гликолиза при анаэробиозе.
Таким образом, скорость катаболизма определяется не концентрацией тех или иных субстратов в среде, а потребностью микробной клетки в энергии.
