
- •Кафедра физики
- •Астраханский государственный технический университет
- •Т.К. Величина du является полным дифференциалом, то из (2) следует, что удельная изохорная теплоемкость равна
- •Для молярных теплоемкостей идеального газа получим формулу Майера
- •Дифференциальное уравнение адиабатного процесса (адиабаты) можно представить в следующем виде
- •Порядок выполнения работы
- •Контрольные вопросы
- •Литература
- •Краткая теория работы
- •Из уравнения (3) с учетом (1) и (2) получим
- •Разность давлений δp может быть измерена дифференциальным манометром, соединённым с капилляром. Эффективный диаметр молекулы определяется по формуле:
- •Описание установки
- •Контрольные вопросы
- •Контрольные вопросы
- •Измерение теплоемкости материалов
- •Порядок выполнения работы
- •Краткая теория
- •Порядок проведения измерений
- •Контрольные вопросы
- •Литература
Т.К. Величина du является полным дифференциалом, то из (2) следует, что удельная изохорная теплоемкость равна
cv
=
![]()
Вещество нагревается при постоянном давлении (P = const).
В этом случае теплота, подводимая к веществу, идёт не только на увеличение его внутренней энергии dU, но и на совершение системой работы dA против внешних сил:
dQ = dU + dA (3)
Следовательно,
удельная теплоёмкость при постоянном
давлении cp
больше удельной теплоёмкости при
постоянном объёме c![]() , т.е. cp
c
.
, т.е. cp
c
.
Первый закон термодинамики для изобарного процесса (dР = 0) можно представить в следующем виде
mcpdT = m(du + Рdυ) = m[d(u+Рυ)- υdР] = mdi, (4)
где i = u+ Рυ – удельная энтальпия вещества (параметр его состояния), Дж/кг.
Для изобарного процесса величина υdР = 0. Отсюда следует, что удельная изобарная теплоемкость вещества равна:
cp
=
![]()
Установим связь между удельными и молярными теплоёмкостями идеального газа для этих процессов. Учитывая, что внутренняя энергия и энтальпия идеального газа зависят только от температуры, а Рυ = RT/M, из (4) получим
d(i –u) = d(Рυ) или (ср - cv)dT =R/M dT.
Отсюда следует, что
ср - cv = R/M.
Для молярных теплоемкостей идеального газа получим формулу Майера
СР - СV = R .
Адиабатным процессом называется такой термодинамический процесс, в котором к системе не подводится и от системы не отводится теплота, т.е.
dQ = 0
Термодинамическую систему, в которой протекает адиабатный процесс, можно представить себе в виде некоторого объема, ограниченного оболочкой с идеальной тепловой изоляцией, не пропускающей теплоту. Такая оболочка называется адиабатной. В реальных условиях процесс можно считать адиабатным, когда система снабжена хорошей теплоизоляцией, или когда процесс протекает настолько быстро, что система не успевает вступить в теплообмен с окружающей средой (например, при быстром сжатии и расширении газа).
Первый закон термодинамики для адиабатного процесса для массы вещества 1 кг приобретает следующий вид:
du = – Рdυ; (5)
di = υdР (6)
Из уравнений (5) и (6) получим:
![]() ,
(7)
,
(7)
где γ – безразмерная величина называется показателем адиабаты или коэффициентом Пуассона.
Дифференциальное уравнение адиабатного процесса (адиабаты) можно представить в следующем виде
dlnР + γ dlnυ =0. (8)
Если показатель адиабаты принять постоянным, то дифференциальное уравнение (8) в следующее:
d(ln(Рυγ) = 0
Интегрируя это уравнение, получим:
ln(Рυγ) = lnconst
или
Рυγ = const; (9)
для любой массы вещества объемом V уравнение (9) имеет вид
РVγ = const.
Уравнение (9) называется уравнением адиабаты или уравнением Пуассона и справедливо и для газа, и для жидкости, и для твердого тела. Если показатель адиабаты изменяется с изменением состояния системы, то можно использовать среднее значение показателя γср.
Реальные газы в области умеренных давлений по своим свойствам приближаются к идеальным газам и для них можно применять соотношения для идеальных газов. Для идеального газа показатель адиабаты с учетом соотношения (7) определяется по формуле:
γ
= ср/сv
= Cp/Cv
= 1+R/Cv
![]()
Приборы, необходимые для выполнения работы
Прибор
Клемана – Дезорма, с помощью которого
можно определить величину
![]() (рис.1). Он представляет собой баллон A с
воздухом, накачиваемым компрессором
K,
до некоторого давления P,
избыток которого Р
= Р
– Р0
над атмосферным р0
определяется по водяному манометру,
соединённому с баллоном шлангом,
(рис.1). Он представляет собой баллон A с
воздухом, накачиваемым компрессором
K,
до некоторого давления P,
избыток которого Р
= Р
– Р0
над атмосферным р0
определяется по водяному манометру,
соединённому с баллоном шлангом,
Р = gh
Для осуществления быстрого (адиабатного) расширения воздуха из баллона в атмосферу служит ручной клапан Кл.
Выделим (мысленно) внутри воздуха, находящегося в баллоне А, некоторую массу газа m и проследим за изменением её состояния во время опыта при одновременном изменении давления Р и температуры Т.
Если клапан Кл открыт, то давление в сосуде равно атмосферному Р0; температура воздуха в сосуде равна T0 – температуре окружающей среды. Тогда параметрами мысленно выделенной массы воздуха будут V0, P0, T0, где V0 – объём рассматриваемой массы воздуха при давлении P0 и температуре T0.
Если теперь закрыть клапан Кл и накачать с помощью компрессора в сосуд некоторое количество воздуха, то рассматриваемая нами масса воздуха сожмётся, а температура и давление её повысятся. Через некоторое время, вследствие теплообмена с окружающей средой, температура воздуха в сосуде станет равной T0. Давление же будет равно:
P1 = P0 + gh1, (10)
где h1 – окончательная (после установления теплового равновесия с окружающей средой) разность уровней жидкости в манометре.
Состояние рассматриваемой массы воздуха определяется теперь параметрами V1, P1, T0 – это 1-ое состояние выделенной массы воздуха; V1 – объём рассматриваемой массы воздуха при давлении P1 и температуре T0.
Если на короткое время (~ 1÷2 с) открыть клапан Кл (рис. 1), то воздух, находящийся в баллоне, быстро (адиабатно) расширится и вследствие этого охладиться. В конце этого малого промежутка времени, в течение которого клапан Кл открыт и баллон сообщается с атмосферой, давление воздуха внутри сосуда станет равным давлению атмосферы P0, и состояние рассматриваемой массы воздуха будет определяться в этот момент следующими параметрами: V2, P0, T1 – 2-ое состояние выделенной массы воздуха, где V2 – объём выделенной массы воздуха. При этом T1 < T0.

Рис.1
Когда давление в сосуде А сделается равным давлению атмосферы (~ 1÷2 с) клапан Кл закрывают. Воздух, находящийся в баллоне, начнёт нагреваться от T1 до T0 вследствие получения тепла от окружающей среды, давление в сосуде начнёт повышаться и станет равным:
P2 = P0 + gh2, (11)
где h2 – разность уровней жидкости в манометре после того, как температура газа в баллоне станет равной температуре окружающей среды.
Рассматриваемая масса воздуха теперь характеризуется параметрами V2, P2, T0 – это 3-е состояние рассматриваемой массы воздуха.
Итак, рассматриваемая масса воздуха во время опыта находилась последовательно в трёх состояниях:
1. V1, P1, T0
2. V2, P0, T1
3. V2, P2, T0
Переход из первого состояния во второе происходит адиабатно, а точки состояний 2 и 3 лежат на изохоре.
На рис.2 изображены графики процессов: кривая 1-2 – адиабата, кривая 2-3 – изохора, кривая 1-3 – изотерма.
Газ в состояниях 1-3 имеет одинаковую температуру T0.
Переход из состояния 1 в состояние 2 описывается уравнением Пуассона:
![]() .
(12)
.
(12)
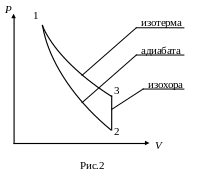
Параметры 1-го и 3-го состояний удовлетворяют закону Бойля – Мариотта:
P1V1 = P2V2 . (13)
Возведя уравнение (13) в степень γ и разделив его почленно на (12), получим
![]() ,
,
отсюда
 .
(14)
.
(14)
Учитывая равенства (9) и (10), получаем, что
P0 = P1 – gh1, P2 = P1 – g(h1 - h2)
и подставляя их в равенство (14), имеем
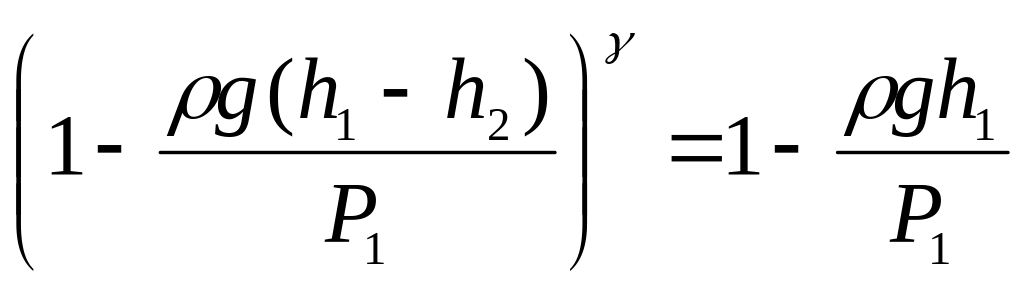 .
(15)
.
(15)
Так как g(h1 – h2) << P1, то разложив левую часть (15) в ряд и ограничившись первым членом разложения, получим
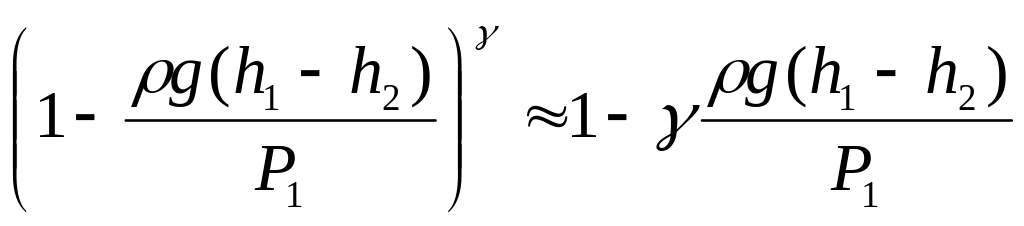 .
(16)
.
(16)
Приравняв правые части (14) и (15), получим следующую формулу:
![]() ,
,
которая используется в этой работе для экспериментального определения γ.
