
Шпоры по общей химии / Вопрос 8 -связь
.docВопрос 8. σ-, π-, δ- связь.
В зависимости от направления перекрывания атомных орбиталей различают σ-, π- и δ-связи.
σ-Связь возникает при перекрывании атомных орбиталей вдоль оси, соединяющей ядра взаимодействующих атомов (рис. II.4). Простейший случай σ-связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (рис. II.4,а). Вследствие сферической формы s-орбиталей два s-электрона могут образовывать только такую связь, при которой перекрывание атомных орбиталей происходит вдоль оси, соединяющей ядра атомов. σ-Связь может возникнуть также при перекрывании s- и р-орбиталей (рис. 11.4,6), двух р-орбиталей (рис. 11,4, в), двух d-орбиталей (рис. II.4, г) d- и s-орбиталей и d- и р-орбиталей. σ-Связь возникает, если атомные р- и d-opбитали ориентированы вдоль оси связи.
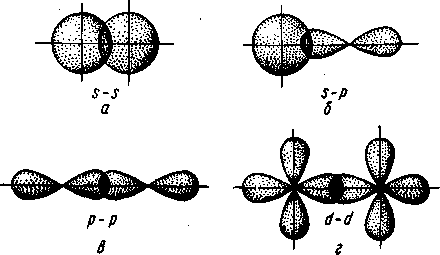
Рис. II.4. Перекрывание различных электронных
облаков при образовании σ–связи
π-Связь осуществляется при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов. При взаимодействии двух р-орбиталей (рис. II.5, а), расположенных перпендикулярно оси, соединяющей ядра атомов, возникают две области перекрывания. Соответственно π-связь характеризуется двумя областями перекрывания, расположенными по обе стороны оси, соединяющей ядра атомов. π-Связь также может образоваться при перекрывании р- и d-орбиталей (рис. 11.5,6) или двух d-opбиталей (рис. П.5,в).
δ-Связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях (рис. II.6). Таким образом, s-электроны могут участвовать лишь в образовании σ-связи, р-электроны — в образовании σ- и π-связей, a d-электроны — как в образовании σ- и π-связей, так и δ-связей. Еще более разнообразны способы взаимодействия f-электронов.
π- и δ-Связи налагаются на σ-связи, вследствие чего образуются двойные и тройные связи.
Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Энергия двойной связи не увеличивается в два раза, а энергия тройной связи не увеличивается в три раза по сравнению с энергией одинарной связи. Это обусловлено разницей в энергии σ- и π-связей.
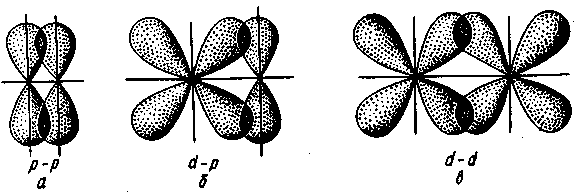
Рис. II.5. Перекрывание электронных
облаков при образовании π-связи
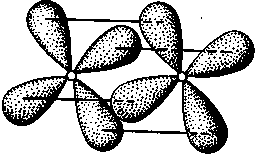
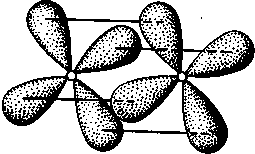
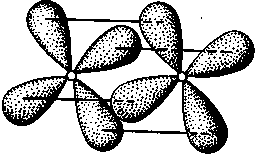
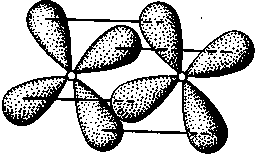
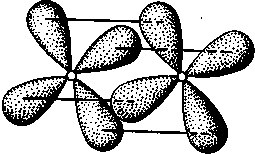
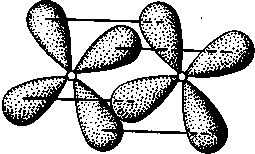
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
Рис. II.6.
Перекрывание электронных
облаков при образовании б-связи
облаков при образовании δ-связи
