
- •Розділ 1. Основні поняття та закони хімії. Хімічний зв'язок. Тема 1.1. Основні закони хімії
- •Закон збереження маси речовини
- •Контрольні запитання:
- •Тема 1.2. Будова атома
- •Сучасні уявлення про будову атома. *
- •Контрольні запитання:
- •Тема 1.3. Будова речовин
- •Основні положення атомно-молекулярного вчення.
- •Контрольні запитання:
- •Тема 1.4. Періодичний закон і періодична система д.І. Менделєєва
- •Періодичний закон.
- •Контрольні запитання:
- •Тема 1.5. Хімічний зв'язок.
- •Поняття про хімічний зв'язок. Типи хімічного зв’язку.
- •Контрольні запитання:
- •Тема 1.6. Міжмолекулярна взаємодія. Типи кристалічних ґраток.
- •Контрольні запитання:
- •Розділ 2. Загальні закономірності хімічних процесів. Тема 2.1. Реакції іонного обміну
- •Контрольні запитання:
- •Тема 2.2. Окисно-відновні реакції
- •Контрольні запитання:
- •Тема 2.3. Енергетика хімічних реакцій
- •Контрольні запитання:
- •Тема 2.4. Хімічна кінетика
- •Контрольні запитання:
- •Тема 2.5. Хімічна рівновага
- •Контрольні запитання:
- •Розділ 3. Дисперсні системи. Розчини. Комплексні речовини. Тема 3.1. Дисперсні системи
- •Контрольні запитання:
- •Тема 3.2. Розчини і розчинність
- •Розчин, його склад.
- •Контрольні запитання:
- •Тема 3.3. Розчини електролітів. Електролітична дисоціація.
- •Контрольні запитання:
- •Тема 3.4. Гідроліз солей.
- •Контрольні запитання:
- •Тема 3.5. Комплексні речовини
- •Координаційна теорія Вернера. *
- •Контрольні запитання:
- •Розділ 4. Основи електрохімії. Тема 4.1. Електрохімічні процеси. Електродні потенціали і електрорушійна сила.
- •Електрохімія. Поняття про електроди.
- •Контрольні запитання:
- •Тема 4.2. Електроліз
- •Поняття про електроліз.
- •Контрольні запитання:
- •Тема 4.3. Корозія металів
- •Корозія металів. Види корозії.
- •Контрольні запитання:
- •Розділ 5. Метали та матеріали Тема 5.1. Метали та їх сплави
- •Загальні властивості металів.
- •Контрольні запитання:
- •Тема 5.2. Одержання металів
- •Добування металів з руд. *
- •Контрольні запитання:
- •Тема 5.3. Магній і берилій.
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.4. Алюміній і титан
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.5. Ванадій, хром і марганець
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.6. Залізо, кобальт, нікель і мідь
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.7. Цинк, галій, олово і свинець
- •Положення в пс і будова атома.
- •Контрольні запитання:
- •Тема 5.8. Інструментальні й абразивні матеріали
- •Бор і його сполуки.*
- •Контрольні запитання:
Контрольні запитання:
Що називається корозією металів?
Які види корозії ви знаєте?
Які процеси відбуваються при корозії цинку в кислому та лужному середовищах.
Література:
Глинка Н.Л. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1979. – Гл. ХVІ, § 196, с. 554-560.
Хомченко Г.П. Химия. – М.: Высшая школа, 1981. – Ч. ІІ, Гл. 12, §§ 99-100, с. 112-114.
Розділ 5. Метали та матеріали Тема 5.1. Метали та їх сплави
План
Загальні властивості металів.
Кристалічна будова металів.*
Сплави. *
1. Метали мають ряд загальних властивостей. Причиною однакових фізичних і хімічних властивостей металів є подібність будови їхніх атомів і природи кристалічних решіток металів. До загальних фізичних властивостей металів належать: висока електропровідність, висока теплопровідність, пластичність, металічний блиск, непрозорість.
Пластичність – здатність деформуватися при звичайній і підвищеній температурі, не руйнуючись. Пластичність металів пояснюється специфічними властивостями металічного зв’язку. При механічному впливі на тверде тіло окремі шари його кристалічної решітки зміщуються відносно один одного. У кристалах з атомною структурою це призводить до розривання ковалентних зв’язків між атомами, що належать різним шарам, і кристал руйнується. У кристалах з йонною структурою при взаємному зміщенні шарів неминуче створюється таке положення, при якому поряд виявляються однойменно заряджені йони. При цьому виникають сили електростатичного відштовхування і кристал також руйнується. При зміщенні окремих шарів кристалічної решітки металу відбувається лише деякий перерозподіл електронного газу, що зв’язує атоми металу один з одним, але хімічні зв’язки не розриваються – метал деформується, не руйнуючись. Завдяки цій властивості метали можна кувати, прокатувати, витягувати в дріт, штампувати.
Металічний блиск зумовлюється здатністю металів добре відбивати світло.
Висока тепло- і електропровідність металів зумовлені можливістю вільного переміщення електронів зони провідності.
З погляду хімії всі метали порівняно легко віддають валентні електрони і, як наслідок цього, здатні утворювати позитивно заряджені йони і виявляти у своїх сполуках тільки позитивну окислюваність. Металів у різних сполуках завжди мають позитивний ступінь окиснення. У зв’язку з цим метали у вільному стані є відновниками. Відновна здатність різних металів неоднакова. Для реакцій у водних розчинах вона визначається положенням металу в ряду напруг і концентрацією його йонів у розчині.
2. Кристалічну будову металів вивчають різними методами. Їх можна розділити на дві групи. До першої належать методи вивчення внутрішньої будови кристалів. До другої – методи вивчення їхніх зовнішніх форм.
Внутрішню будову кристалів вивчають, головним чином, за допомогою рентгеноструктурного аналізу. За його даними для всіх металів установлено типи і параметри кристалічних граток.
Кристалічні гратки металів можуть бути різних типів. Однак для більшості металів характерні три типи граток:
об’ємноцентрована кубічна (Li, Na, K, V, Cr, Fe(при температурах до 912ºС і від 1394ºС до плавлення), Pb, W)
гранецентрована кубічна (Al, Fe(від 912ºС до 1394ºС), Ca, Ni, Cu, Ag, Au)
гексагональна (Be, Mg, Cd, Ti, Co, Zn)
а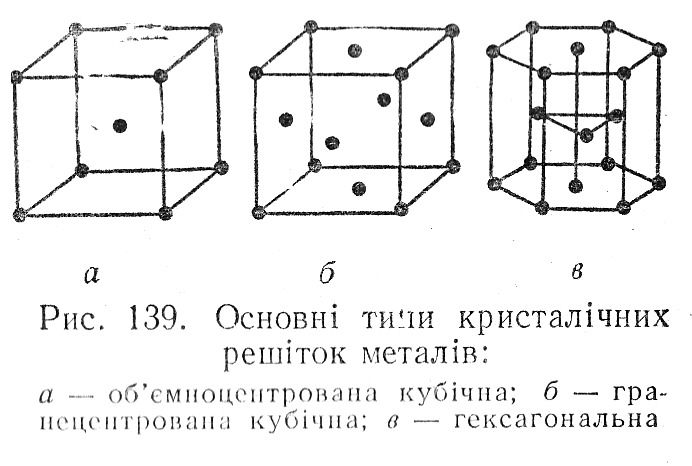 )
об’ємноцентрована кубічна
)
об’ємноцентрована кубічна
б) гранецентрована кубічна
в) гексагональна
Розміри, форму і взаємне розміщення кристалів у металах вивчають металографічними методами. Найповнішу оцінку структури металу з цього погляду дає мікроскопічний аналіз його шліфу. З досліджуваного металу вирізають зразок і його площину шліфують, полірують і протравлюють спеціальним розчином (травником). В результаті травлення виявляється структура зразка, яку розглядають або фотографують за допомогою металографічного мікроскопа.
К ристали
металів звичайно мають невеликі розміри.
Тому будь-який металевий виріб складається
з великої кількості кристалів. Така
структура називається полікристалічною.
При кристалізації металу з розплавленого
стану кристали, що ростуть, заважають
один одному набувати правильної форми.
Тому кристали полікристалічного тіла
мають неправильну форму і на відміну
від правильно огранованих кристалів
називаються кристалітами, або зернами.
Зерна розрізняються між собою просторовою
орієнтацією їхніх кристалічних решіток.
ристали
металів звичайно мають невеликі розміри.
Тому будь-який металевий виріб складається
з великої кількості кристалів. Така
структура називається полікристалічною.
При кристалізації металу з розплавленого
стану кристали, що ростуть, заважають
один одному набувати правильної форми.
Тому кристали полікристалічного тіла
мають неправильну форму і на відміну
від правильно огранованих кристалів
називаються кристалітами, або зернами.
Зерна розрізняються між собою просторовою
орієнтацією їхніх кристалічних решіток.
Схема різної орієнтації кристалічних решіток у полікристалічному тілі
П ри
травленні шліфу межі зерен роз’їдаються
більше; вони стають поглибленими. Світло,
падаючи на них, розсіюється, і в полі
зору мікроскопа межі зерен здаються
темними, а самі зерна – світлими.
ри
травленні шліфу межі зерен роз’їдаються
більше; вони стають поглибленими. Світло,
падаючи на них, розсіюється, і в полі
зору мікроскопа межі зерен здаються
темними, а самі зерна – світлими.
Внутрішня структура зерна металу не є точно правильною. Металам властиві дефекти структури.
3. Сплав – суміш якого-небудь металу з одним або кількома іншими елементами.
 У
рідкому стані більшість металів
розчиняються один в одному і утворюють
однорідний рідкий сплав. У процесі
кристалізації з розплавленого стану
різні метали поводять себе по-різному,
що зумовлює існування таких трьох типів
сплавів:
У
рідкому стані більшість металів
розчиняються один в одному і утворюють
однорідний рідкий сплав. У процесі
кристалізації з розплавленого стану
різні метали поводять себе по-різному,
що зумовлює існування таких трьох типів
сплавів:
1) У твердому стані метали, що сплавляються, не розчиняються один в одному і хімічно не взаємодіють один з одним. За цих умов сплав є хімічною сумішшю і складається з кристалітів одного і другого компонентів, які чітко видно на мікрошліфі.
2 )
Метали, які сплавляються, взаємодіють
один з одним, утворюючи хімічну сполуку.
)
Метали, які сплавляються, взаємодіють
один з одним, утворюючи хімічну сполуку.
3) У процесі кристалізації з розплаву розчинність металів один в одному зберігається. Утворюються однорідні кристали. У цьому випадку тверда фаза називається твердим розчином. При цьому для одних металів взаємна розчинність їх у твердому стані не обмежена, інші ж розчиняються один в одному лише до певних концентрацій.
