
Отчеты по лабораторным работам / лаба 3 / лаба 3
.docЦель работы: Определить концентрацию растворов кислоты титрованием раствором щелочи.
Теоретическая часть:
-
Титрование – это постепенное приливание титрованного раствора к раствору анализируемого вещества.
-
Нормальная концентрация – число эквивалентов растворенного вещества в 1 л раствора.
Сn
=
![]() ;
;
где в – растворенное вещество. Сn =[экв/л];
3. Молярная концентрация – число молей растворенного вещества содержащегося в 1000 г. чистого растворителя.
Сm
=
![]() =
[моль/л]
=
[моль/л]
4.Задача:
 Дано:
Решение:
Дано:
Решение:
V(HCl) = 25мл = 0,025л NaOH + HCl = NaCl + H2O
V(NaOH) = 30мл = 0,03л
С(NaOH) = 0,1 NK ∙ VK = NЩ ∙ VЩ

N(HCl)
= ? ; Сm(HCl)
= ? N(HCl)
=![]()
N(HСl)
=
![]() = 0,12(моль/л)
= 0,12(моль/л)
Сm(HCl)
=
![]() ;
Сm(HCl)
=
;
Сm(HCl)
=
![]() (моль/л)
(моль/л)
Ответ: N(HCl) = 0,12(моль/л)
Сm(HCl) = 0,12(моль/л)
Реактивы и посуда:
-
4 конические колбы 150 мл;
-
бюретка на 25 мл;
-
пипетка на 10 мл;
-
мерные цилиндр на 10 и 25 мл;
-
индикатор метилоранж;
-
0,1 H раствора NaOH;
-
раствор HCl неизвестной концентрации;
-
раствор H2SO4 неизвестной концентрации;
Опыт I: Определение концентрации соляной кислоты.
Ход работы: Отобрать пипеткой в коническую колбу 5 мл раствора кислоты, добавить дистиллированной воды до 15-20 мл, внести 2-3 капли индикатора. Раствор щелочи поместить в бюретку, довести уровень в бюретку до нуля. Провести ориентировочный опыт – титрование HCl раствором NaOH добавляя небольшими порциями щелочь из бюретки в колбу до изменения окраски раствора.
Затем в 4 конические колбы отобрать по 5 мл раствора кислоты, добавить дистиллированной воды и внести индикатор. оставить одну колбу в качестве контрольной, а с тремя повторить титрование, но более точно. Последние порции прибавлять по каплям. Определить объем, израсходованной щелочи и заполнить таблицу:
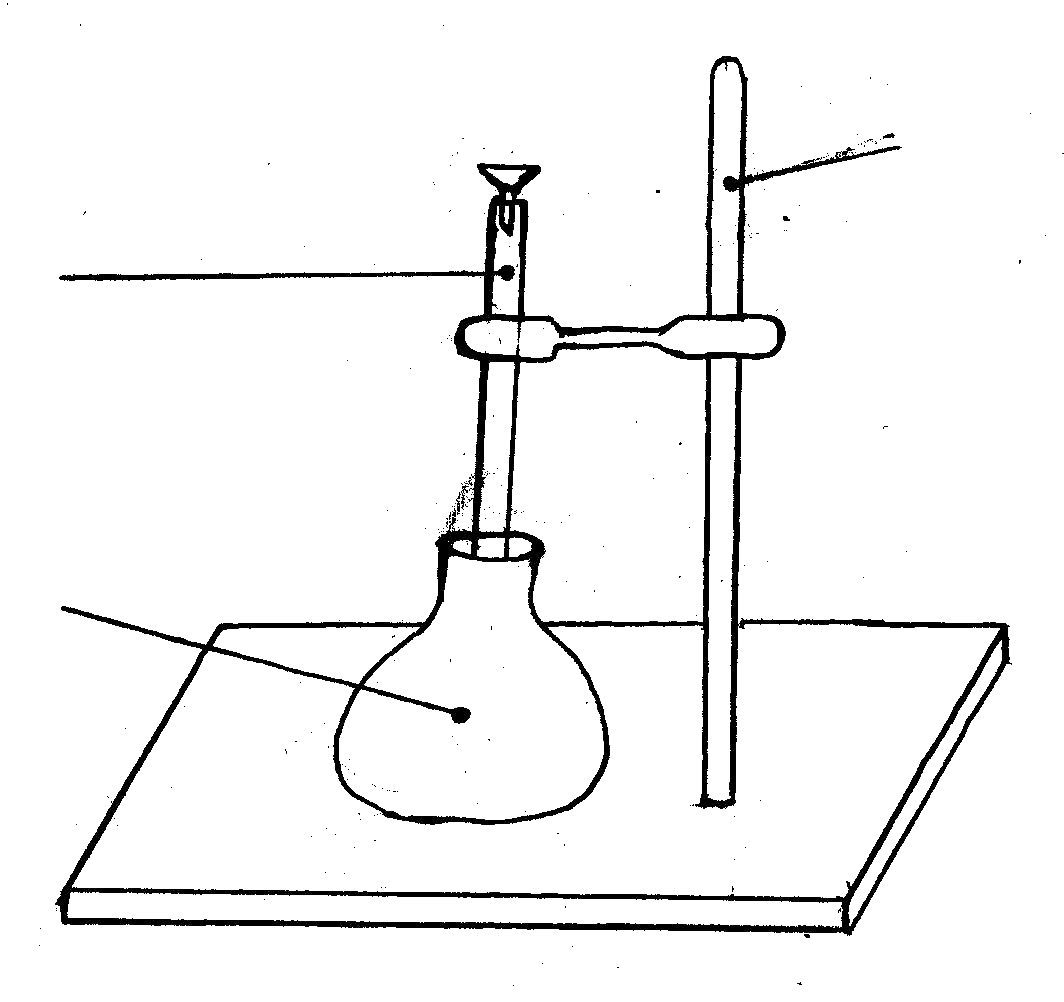
штатив
бюретка
коническая
колба
Прибор для титрования
|
№ опыта |
Объем раствора кислоты, мл |
Индикатор, число капель |
Объем израсходованного раствора щелочи, мл |
|
1 |
5 |
2 |
4,7 |
|
2 |
5 |
2 |
4,8 |
|
3 |
5 |
2 |
5,1 |
|
|
Среднее значение - 4,9 |
||
HCl + NaOH = NaCl + H2O;
H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O;
NK ∙ VK = NЩ ∙ VЩ
N(HCl)
=![]()
N(HСl)
=
![]() = 0,098(моль/л)
= 0,098(моль/л)
Сm(HCl)
=
![]() ;
Сm(HCl)
=
;
Сm(HCl)
=
![]() (моль/л)
(моль/л)
Опыт II: Определение концентрации серной кислоты.
|
№ опыта |
Объем раствора кислоты, мл |
Индикатор, число капель |
Объем израсходованного раствора щелочи, мл |
|
1 |
5 |
2 |
5,1 |
|
2 |
5 |
2 |
4,9 |
|
3 |
5 |
2 |
5,0 |
|
|
Среднее значение – 5,0 |
||
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
2H+ + SO4- + 2Na+ + OH- = 2Na+ + SO4- + 2 H2O;
NK ∙ VK = NЩ ∙ VЩ
N(![]() )
=
)
=![]()
N(![]() )
=
)
=
![]() = 0,1(моль/л)
= 0,1(моль/л)
Сm(HCl)
=
![]() ;
Сm(HCl)
=
;
Сm(HCl)
=
![]() (моль/л)
(моль/л)
Вывод: Титрование определены концентрации растворов HCl и H2SO4.
Нормальная концентрация HCl равна 0,098 (моль/л);
Молярная концентрация HCl равна 0,098 (моль/л);
Нормальная концентрация H2SO4 равна 0,1(моль/л);
Молярная концентрация H2SO4 равна 0,05 (моль/л).
