
- •Контролируемая самостоятельная работа студента по химии
- •1. Химические источники тока (общее понятие).
- •Характеристики химических источников тока
- •2. Свинцовые (кислотные) аккумуляторы.
- •2.1 История создания
- •2.2 Электрохимические и другие физико-химические процессы
- •2.3. Конструкция и технология свинцовых аккумуляторов
- •2.4. Характеристики
- •2.5. Дальнейшее совершенствование свинцовых аккумуляторов
- •3. Pb – металл, входящий в состав электрода хит
- •3.1.Свойства
- •2.Химические свойства
- •3.Применение
- •Список литературы
2.2 Электрохимические и другие физико-химические процессы
а) Токообразующие реакции
Заряженный отрицательный электрод свинцового аккумулятора содержит губчатый свинец, положительный — двуокись свинца РbО2; электролитом служит раствор серной кислоты. Токообразующие реакции описываются уравнениями:
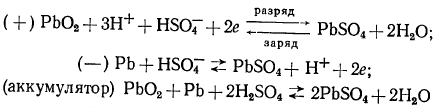
(при используемых концентрациях серная кислота диссоциирует практически только на ионы Нˉ и HSO7ˉ)
Таким образом, при разряде аккумулятора расходуется серная кислота, а на обоих электродах образуется малорастворимый сульфат свинца. Представления о таком механизме реакции были высказаны еще в 1883 г. Дж. Гладстоном и А. Трайбом в их теории «двойной сульфатации».
Напряжение разомкнутой цепи (в вольтах) свинцового аккумулятора совпадает с термодинамическим значением ЭДС и равно при 25 °С:

(с точностью ±0,002 В), где aH2SO4 — активность серной кислоты и aH2O — активность воды.
Зависимости активностей серной кислоты и воды, а также значений ЭДС от концентрации серной кислоты приведеныв табл. 9.1. В данной главе будут использованы массовые доли (проценты) g — количество серной кислоты (в граммах) в 100 г раствора. Часто концентрацию раствора серной кислоты определяют путем измерения его плотности.
Таблица 9.1
Активность серной кислоты и воды и термодинамические значения ЭДС свинцового аккумулятора в растворах серной кислоты разной концентрации (при 25 °С)
|
Плотность раствора. т/м3 |
Концентрация |
Активность |
ЭДС ЕТ, В | ||
|
массовая доля g, % |
молярная с. моль/л |
серной кислоты aH2SO4 |
воды aH2O | ||
|
1,050 |
8 |
0,86 |
0,0069 |
0,96 |
1,922 |
|
1,078 |
12 |
1,32 |
0,021 |
0,94 |
1,951 |
|
1,106 |
16 |
1,81 |
0,060 |
0,91 |
1,979 |
|
1,136 |
20 |
2,32 |
0,159 |
0,88 |
2,005 |
|
1,167 |
24 |
2,86 |
0,424 |
0,84 |
2,031 |
|
1,200 |
28 |
3,43 |
1,14 |
0,78 |
2,059 |
|
1,231 |
32 |
4,03 |
3,28 |
0,72 |
2,088 |
|
1,264 |
36 |
4,66 |
10,8 |
0,65 |
2,121 |
|
1,300 |
40 |
5,31 |
34,6 |
0,57 |
2,154 |
|
1,334 |
44 |
6,00 |
118 |
0,48 |
2.190 |
Примечание. Концентрация в граммах на литр равна 98с (98 — молекулярная масса серной кислоты); моляльная концентрация m (моли серной кислоты на 1000 г воды) равна 1000 g/98(100 — g).
Двуокись свинца существует в двух модификациях, различающихся кристаллической структурой: орторомбической α-РbО2 и тетрагональной β-РbО2. Равновесный потенциал α-РbО2 на 0,01 В положительнее потенциала β-PbO2. Обычно в заряженном электроде имеются обе модификации. Как α-РЬО2, так и β-РЬО2 не являются в полной мере стехиометрическими соединениями; их состав может быть представлен как РbОx, где х колеблется от 1,85 до 2,05.
б) Особенности разряда и заряда
Рис. 9.1. Типичные
разрядная
и зарядная
кривые свинцового
аккумулятора.
 ри
разряде на обоих электродах образуется
сульфат свинца, удельная электрическая
проводимость которого (в отличие от
проводимости свинца и двуокиси свинца)
очень низка — меньше 10-6
См/м. Сульфат свинца и двуокись свинца
слабо растворимы в серной кислоте и
образуют ионы соответственно Рb2+
и РbО(ОН)ˉ
в концентрации 10-6 –
10-5 моль/л;
при увеличении концентрации серной
кислоты концентрация первых ионов
уменьшается, вторых — увеличивается.
В связи с этим токообразующие реакции
идут в основном через раствор, с
промежуточным образованием растворимых
продуктов. Большое значение для работы
электродов имеет их пористая структура,
обеспечивающая доступ серной кислоты
в глубину электрода. Пористость
заряженных электродов доходитдо
50 %; средний диаметр пор положительного
электрода равен 1-2 мкм, отрицательного
- 10 мкм. В ходе разряда пористость сильно
уменьшается, так как удельный объем
сульфата свинца больше удельных объемов
свинца и двуокиси свинца.
Для свинцовых аккумуляторов характерно
сильное разбавление электролита во
время разряда из-за потребления серной
кислоты и образования воды. В заряженных
аккумуляторах концентрация серной
кислоты равна 28 - 40 % (в зависимости от
типа). Чем меньше объем электролита по
сравнению с количеством активных масс
электродов, тем сильнее снижается
концентрация при разряде; в конце разряда
она колеблется от 12 до 24 %. Соответственно
НРЦ заряженного аккумулятора равно
2,06— 2,15 В, а почти разряженного 1,95—2,03
В. Степень снижения концентрации для
данного аккумулятора однозначно связана
с количеством протекшего электричества.
Поэтому измерение концентрации или
плотности электролита служит удобным
и точным средством определения степени
заряженности аккумулятора. В этом
отношении свинцовый аккумулятор выгодно
отличается от других аккумуляторов. В
ходе разряда объем электролита уменьшается
примерно на 1 мл на каждый ампер-час.
ри
разряде на обоих электродах образуется
сульфат свинца, удельная электрическая
проводимость которого (в отличие от
проводимости свинца и двуокиси свинца)
очень низка — меньше 10-6
См/м. Сульфат свинца и двуокись свинца
слабо растворимы в серной кислоте и
образуют ионы соответственно Рb2+
и РbО(ОН)ˉ
в концентрации 10-6 –
10-5 моль/л;
при увеличении концентрации серной
кислоты концентрация первых ионов
уменьшается, вторых — увеличивается.
В связи с этим токообразующие реакции
идут в основном через раствор, с
промежуточным образованием растворимых
продуктов. Большое значение для работы
электродов имеет их пористая структура,
обеспечивающая доступ серной кислоты
в глубину электрода. Пористость
заряженных электродов доходитдо
50 %; средний диаметр пор положительного
электрода равен 1-2 мкм, отрицательного
- 10 мкм. В ходе разряда пористость сильно
уменьшается, так как удельный объем
сульфата свинца больше удельных объемов
свинца и двуокиси свинца.
Для свинцовых аккумуляторов характерно
сильное разбавление электролита во
время разряда из-за потребления серной
кислоты и образования воды. В заряженных
аккумуляторах концентрация серной
кислоты равна 28 - 40 % (в зависимости от
типа). Чем меньше объем электролита по
сравнению с количеством активных масс
электродов, тем сильнее снижается
концентрация при разряде; в конце разряда
она колеблется от 12 до 24 %. Соответственно
НРЦ заряженного аккумулятора равно
2,06— 2,15 В, а почти разряженного 1,95—2,03
В. Степень снижения концентрации для
данного аккумулятора однозначно связана
с количеством протекшего электричества.
Поэтому измерение концентрации или
плотности электролита служит удобным
и точным средством определения степени
заряженности аккумулятора. В этом
отношении свинцовый аккумулятор выгодно
отличается от других аккумуляторов. В
ходе разряда объем электролита уменьшается
примерно на 1 мл на каждый ампер-час.
На рис. 9.1 показаны разрядная и зарядная кривые одного из типов свинцового аккумулятора при j=0,1; пунктиром показаны изменения НРЦ в ходе разряда и заряда, связанные с изменением концентрации кислоты. В самом начале разряда напряжение может быть несколько повышенным из-за образования при заряде небольшого количества РbОX, где х>2. После начала разряда наблюдается небольшой провал напряжения, обусловленный затруднениями начала кристаллизации сульфата на свинце и на РbО2 и возникающим из-за этого временным пересыщением раствора ионами Рb2+. После стабилизации этих быстро протекающих изменений в ходе дальнейшего разряда напряжение медленно снижается. Одной из причин является снижение НРЦ. Кроме того, по мере распространения реакций в глубь активных масс и уменьшения пористости масс усиливаются концентрационная поляризация и омические потери в пористых электродах.
Разряд аккумуляторов в обычных условиях ограничивается положительным электродом; в отдельных случаях, например при низких температурах, лимитирующим становится отрицательный электрод. При малом количестве электролита разряд может ограничиваться из-за разбавления серной кислоты. Если g1 - начальная, a g2 - минимально допустимая концентрация (в процентах), то 1 кг исходного раствора по уравнению реакции обеспечивает разрядную емкость (в А·ч):
Q = 103(g1- g2)/(366-3 g2). (9.3)
При заряде напряжение аккумулятора постепенно повышается из-за роста НРЦ и распространения процесса в глубь электрода. После глубокого разряда в самом начале заряда иногда появляется четкий максимум напряжения; он связан с омическим сопротивлением плотного слоя сульфата свинца, который после начала восстановления быстро растрескивается. Заряд отрицательного электрода не сопровождается побочными процессами. После превращения основной массы сульфата потенциал электрода (и напряжение аккумулятора) резко подскакивает и начинается выделение водорода. На положительном электроде небольшое количество кислорода выделяется уже во время заряда. Поэтому отдача электрода по емкости составляет 85—90 %. Для получения полной разрядной емкости аккумулятору при заряде после скачка напряжения сообщают еще 10—20 % емкости; этот перезаряд сопровождается обильным выделением водорода и кислорода («кипение» электролита).
