
- •1. Назначение химических источников тока. Их роль в народном хозяйстве
- •2. История открытия и описание серебряно-водородного аккумулятора
- •3. Электрохимические и другие физико-химические процессы в источнике тока
- •4. Электронное строение серебра и его положение в периодической системе в. И. Менделеева
- •5. Кристаллическая структура серебра
- •6. Важнейшие физические свойства серебра
- •7. Механические свойства серебра
- •8. Взаимодействие серебра с простыми и сложными окислителями
- •9. Термодинамика и кинетика серебра
- •10. Важнейшие соединения серебра
- •11. Роль серебра в работе серебряно-водородного аккумулятора
- •12. Перспективы дальнейшего развития серебряно-водородных аккумуляторов
- •Литература
3. Электрохимические и другие физико-химические процессы в источнике тока
Аккумулятор состоит из положительного электрода – окиси серебра и отрицательного электрода – водородного электрода с платиновым катализатором (50-100 г/м2). Электроды разделяются между собой матрицей. Батарея аккумуляторов помещается в прочный бал-лон, в котором хранится под давлением водород, образующийся при заряде аккумулятора.
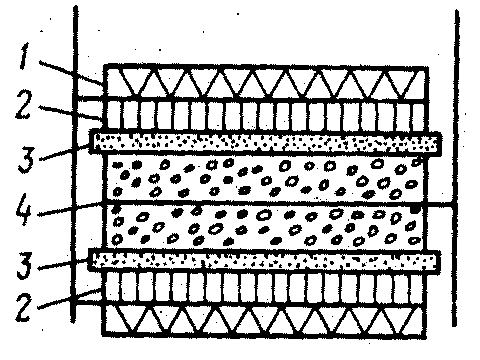
Схема серебряно-водородного аккумулятора.
1-газодиффузионная сетка из тефлона; 2-водородный электрод с платиновым катализатором; 3-матричный электролит; 4-серебряный электрод.
Электрохимическая схема серебряно-водородного аккумулятора имеет вид:
(–) Pt| KOH | Ag2O (+)
В аккумуляторе водородный электрод используется как в разрядном, так и в зарядном режиме, т.е. он работает попеременно как анод и как катод. В отличие от кислородного (воздушного) электрода обратимость водородного электрода высока. При разряде и при заряде поляризация невелика, анодный процесс не сказывается вредно на катодном, и наоборот. Другая особенность водородного электрода состоит в том, что он работает при переменном давлении газа – в начале разряда оно максимально, а в конце минимально.
При заряде аккумулятора:
2Н++ 2е–= Н2(на катоде)
![]()
Ag+ ½HOH–е–= ½ Ag2O +H+(на аноде)
Ag0 – е– → Ag+| 2
2H2O+ 2e–→H2+ 2OH–| 1
![]()
При заряде выделяется водород, который накапливается под давлением.
Серебряно-водородный аккумулятор допускает перезаряд без опасности выхода из строя. После окончания заряда положительного серебряного электрода на нем начинается анодный процесс выделения кислорода. Через газовые поры в матрице кислород легко поступает на водородный электрод и там каталитически соединяется с водородом с образованием воды:
H2+ ½O2= H2O
![]()
Единственным результатом такого перезаряда является значительное выделение тепла. Давление водорода достигает некоторого стационарного значения и дальше в результате взаимодействия водорода и кислорода не нарастает.
При разряде аккумулятора:
H2– 2 е–= 2H+(на аноде)
![]()
½ Ag2O +H++е– =Ag+ ½HOH(на катоде)
Ag+ + е– → Ag0| 2
H2+ 2OH– → 2H2O+ 2e–| 1
![]()
При разряде водород расходуется и давление его уменьшается.
Серебряно-водородный аккумулятор является одним из немногих ХИТ, которые при эксплуатации в составе батарей не боятся переразряда и переполюсовки. Ограничителем емкости при разряде делают положительный электрод; при его полном разряде в баллоне остается некоторое остаточное давление водорода (обычно 0,4—0,6 МПа). При переразря-де положительного электрода на нем начинается катодное выделение водорода и происходит переполюсовка аккумулятора:
2Н++ 2 е–= Н2
![]()
Количество образующегося на катоде водорода соответствует водороду, вступающему в реакцию на аноде; таким образом, давление газа дальше не меняется. Выделение водоро-да на серебряном электроде не вызывает его порчи.
Указанные свойства – нечувствительность к перезаряду и переразряду (даже при срав-нительно больших токах) – имеют большое значение, так как упрощают эксплуатацию аккумуляторов и делают ее безопасной.
Удобным для эксплуатации аккумуляторов (кроме вариантов с поглотителем) является то, что посредством измерения давления газа в баллоне легко определить степень заря-женности аккумулятора.
Хотя непосредственное взаимодействие водорода с заряженным серебряным электро-дом замедленно, оно все же происходит и приводит к довольно существенному само-разряду: заряженный аккумулятор теряет при комнатной температуре 6— 12 % емкости в сутки.
Фактором, снижающим ресурс, является коррозия основы положительного электрода, в ходе которой потребляется вода. Вследствие этого постепенно уменьшается количество раствора в матрице и увеличивается внутреннее сопротивление. Коррозия усиливается во время заряда, когда в результате концентрационной поляризации рН раствора в порах электрода падает; особенно велика она при перезаряде. Высыхание матрицы может быть замедлено путем использования электродов и матрицы с большим объемом пор, пропи-танных электролитом, а также путем правильного подбора капиллярной структуры этих сред, увеличивающего «буферную емкость» системы.
