- •2. Термодинамические аспекты поверхности
- •2.1. Химический потенциал. Свободная энергия Гиббса и Гельмгольца
- •2.2 Поверхностная энергия и её анизотропия. Поверхностное натяжение
- •2.3. Процессы на поверхности и в приповерхностных слоях
- •2.3.1. Физическая и химическая адсорбция
- •2.3.2 Кинетика процесса физической адсорбции. Уравнения изотермы
- •2.3.3. Адсорбция на границе жидкий раствор - газ. Поверхностно-активные вещества
- •2.3.4. Адсорбция на границе твердое тело – жидкий раствор
- •2.3.5. Адгезия и смачивание
- •2.3.6. Свойства наноструктурированных поверхностей
2.3.3. Адсорбция на границе жидкий раствор - газ. Поверхностно-активные вещества
Адсорбция на границе жидкий раствор - газ заключается в концентрировании растворенного в жидкости вещества на поверхности раздела жидкого раствора и газа.
Для таких систем характерны следующие особенности:
1. поверхность жидкости равноценна для адсорбции, так как однородна;
2. молекулы растворенного вещества не закреплены на определенных участках поверхности и могут свободно передвигаться;
3. силы взаимодействия между молекулами газа малы, и ими можно пренебречь;
Гиббсовская адсорбция равняется удельному избытку числа молей i-го сорта в поверхностном слое:
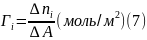
где
 – площадь элемента поверхности границы
раздела фаз.
– площадь элемента поверхности границы
раздела фаз.
Следует
иметь в виду, что молекулярное силовое
поле в переходном слое всегда запасает
избыточную энергию, что дает σ
> 0. В то же время это поле может одни
частицы втягивать в слой, а другие
выталкивать из него, обеспечивая
алгебраические избытки
 разных знаков, что дает
разных знаков, что дает
 или < 0.
или < 0.
Образование межфазного слоя происходит в условиях постоянного объема, т.о. термодинамической функцией, подходящей для описания, является изохорный потенциал F. На основании вышесказанного, избыток ΔF для поверхностного слоя можно представить в виде суммы двух слагаемых:
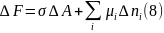
Первое
слагаемое учитывает увеличение свободной
энергии за счет сил поверхностного
натяжения (σ
> 0), а второе слагаемое – ее изменение
за счет алгебраического избытка числа
молей в поверхностном слое (
> 0 или < 0), при этом
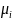 – химический потенциал частиц i-го
сорта. Разделив левую и правую части
равенства (8) на
,
получим выражение для удельной свободной
энергии поверхностного слоя Fs
= F/
:
– химический потенциал частиц i-го
сорта. Разделив левую и правую части
равенства (8) на
,
получим выражение для удельной свободной
энергии поверхностного слоя Fs
= F/
:
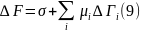
Поверхностное натяжение σ и гиббсовская адсорбция должны быть связаны между собой, поскольку их образование вызвано общей причиной – силовым полем поверхностных молекулярных сил. Для установления этой связи рассмотрим поверхность раздела фаз площадью А и запишем для межфазного слоя дифференциал полной свободной энергии FSA, используя выражение (9):
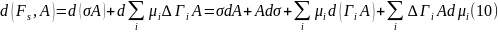
Выразим
дифференциал
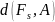 другим способом, исходя из известного
выражения для объемной фазы, а именно:
другим способом, исходя из известного
выражения для объемной фазы, а именно:
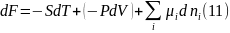
где
второе слагаемое (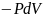 )
> 0 отражает работу, производимую над
системой при ее сжатии (dV
< 0), что увеличивает энергию системы.
По аналогии с этим выражением для
межфазного слоя записываем
)
> 0 отражает работу, производимую над
системой при ее сжатии (dV
< 0), что увеличивает энергию системы.
По аналогии с этим выражением для
межфазного слоя записываем
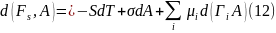
где
работа
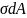 > 0, производимая при увеличении
поверхности слоя (dA
> 0), приводит к увеличению энергии,
запасенной в этом слое.
> 0, производимая при увеличении
поверхности слоя (dA
> 0), приводит к увеличению энергии,
запасенной в этом слое.
Приравняв выражения (10) и (12), получаем равенство
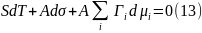
которое является аналогом соотношения Гиббса-Дюгема, относящимся к поверхности. Отсюда для изотермических условий (Т = const) получаем соотношение:
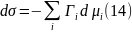
называемое адсорбционным уравнением Гиббса.
Из выражения (14) как полного дифференциала следует искомая связь между гиббсовской адсорбцией частиц i-го сорта и поверхностным натяжением в виде:
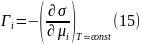
Рассмотрим
жидкий раствор, содержащий растворенное
i-е
вещество в достаточно малой концентрации
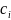 ,
так, что его химический потенциал равен:
,
так, что его химический потенциал равен:
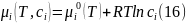
Переписываем выражение (15) с учетом производной, получаемой из формулы (16), в следующей форме:
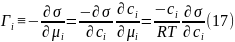
и получаем уравнение Гиббса (17), широко используемое для адсорбции неэлектролитов. Уравнение Гиббса не позволяет однозначно описать концентрационную зависимость адсорбции при постоянной температуре, т.е. изотерму адсорбции. Рассмотрим физические следствия, вытекающие из соотношения (17).
1.
Если с ростом концентрации растворенного
вещества поверхностное натяжение
раствора снижается, т. е.
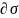 /
/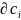 < 0, то гиббсовская адсорбция такого
вещества положительна:
> 0 или
< 0, то гиббсовская адсорбция такого
вещества положительна:
> 0 или
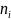 > (
> (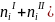 .
Следовательно, концентрация вещества
в поверхностном слое превышает его
концентрацию в растворе. Такие вещества,
накапливаемые на поверхности, называются
поверхностно-активными веществами
(ПАВ). К растворам с подобными свойствами
относятся растворы с положительным
отклонением от закона Рауля. Для них
процесс растворения является
эндотермическим (ΔН
> 0). Это является следствием того, что
взаимодействие между одинаковыми
молекулами растворителя сильнее, чем
между разнородными молекулами растворителя
и растворенного вещества. Поэтому
энергетически невыгодно введение в
растворитель такого вещества, его
молекулы преимущественно вытесняются
из раствора на поверхность (
> 0). Вследствие накопления адсорбированных
молекул на поверхности жидкости
межмолекулярное взаимодействие в
поверхностном слое уменьшается и
поверхностное натяжение падает.
.
Следовательно, концентрация вещества
в поверхностном слое превышает его
концентрацию в растворе. Такие вещества,
накапливаемые на поверхности, называются
поверхностно-активными веществами
(ПАВ). К растворам с подобными свойствами
относятся растворы с положительным
отклонением от закона Рауля. Для них
процесс растворения является
эндотермическим (ΔН
> 0). Это является следствием того, что
взаимодействие между одинаковыми
молекулами растворителя сильнее, чем
между разнородными молекулами растворителя
и растворенного вещества. Поэтому
энергетически невыгодно введение в
растворитель такого вещества, его
молекулы преимущественно вытесняются
из раствора на поверхность (
> 0). Вследствие накопления адсорбированных
молекул на поверхности жидкости
межмолекулярное взаимодействие в
поверхностном слое уменьшается и
поверхностное натяжение падает.
Примером ПАВ являются молекулы линейных углеводородов, на одном конце молекул которых имеются полярные группы. Примером ПАВ являются соли высших жирных кислот, водные растворы которых используются для очистки различных поверхностей от загрязнения. Их молекулы в форме длинного углеводородного радикала, несмачиваемого водой, имеют на конце полярную группу типа СООН, сильно взаимодействующую с полярными молекулами воды. Однако, в целом, взаимодействие вода - вода сильнее, чем вода – ПАВ. Поэтому вода вытесняет гидрофобные радикалы ПАВ из своего объема, и молекулы ПАВ располагаются на поверхности раствора полярными группами вниз, а неполярными вертикально вверх в сторону воздуха. Выталкивание и концентрирование молекул ПАВ на поверхности воды уменьшает интенсивность силового поля и снижает поверхностное натяжение воды.
|
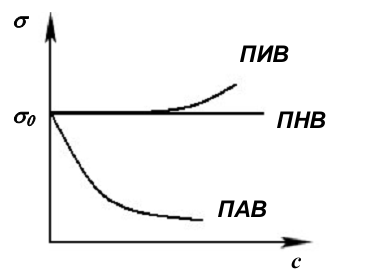
Рис.7. Зависимость поверхностного натяжения от концентрации растворовПАВ, ПИВ и ПНВ, где σ0 – поверхностное натяжение растворителя |
Вещества, растворение которых не приводит к изменению поверхностного натяжения, называются поверхностно-неактивными веществами. Это органические вещества, у которых много полярных групп, например, сахароза, глюкоза.
|
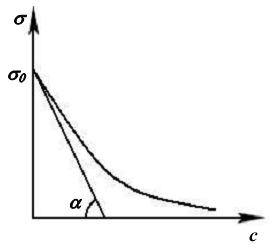
Рис.8. Графическое определение поверхностной активности ПАВ |
Для того, чтобы рассчитать избыточную адсорбцию по уравнению Гиббса, надо знать производную d /dc, которая имеет различные численные значения при различных концентрациях раствора. Чтобы было удобней сравнивать влияние различных ПАВ на данную поверхность раздела, сравнивают производные (-d /dc) при с → 0.
Величина (-d /dc)с → 0 называется поверхностной активностью ПАВ, которая обозначается g (в честь Дж. Гиббса) и измеряется в Дж·м·моль-1.
|
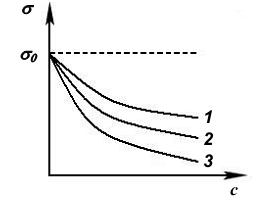
Рис.9. Изотермы поверхностного натяжения водных растворов: 1 - изопропилового спирта, C3H7OH; 2 – бутилового спирта, C4H9OH; 3 – гексилового спирта, C6H13OH |
В соответствии с геометрической трактовкой первой производной:
g = (-d /dc)с→0 = tgα.
Величина поверхностной активности зависит от длины углеводородного радикала. Об этом говорит эмпирическое правило Дюкло-Траубе: Поверхностная активность ПАВ на границе их водных растворов с газом увеличивается в 3 – 3,5 раза при увеличении углеводородной цепи на одну группу -СН2. Графически это правило продемонстрируем на примере гомологического ряда спиртов (рис.9).
Из рис. 9 видно, что чем круче кривая, тем больше поверхностная активность:
g (C3H7OH) < g (C4H9OH) < g (C6H13OH).
Если
известна кривая
=
f(c),
то можно вычислить избыточную адсорбцию
для нескольких концентраций
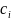 и построить изотерму адсорбции
и построить изотерму адсорбции
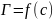 .
Для этого необходимо провести касательные
к точкам (
,
.
Для этого необходимо провести касательные
к точкам (
,
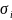 )
на кривой
(c), определить tgαi
=-d
i/dci
и рассчитать
по уравнению Гиббса.
)
на кривой
(c), определить tgαi
=-d
i/dci
и рассчитать
по уравнению Гиббса.
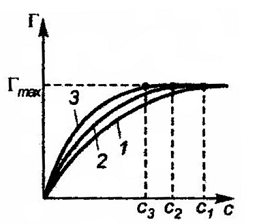
Определив значения избыточной адсорбции не менее, чем для пяти различных концентраций, строят изотерму адсорбции Г = f(c) (рис.10).
|
Рис.10. Изотермы адсорбции водных растворов: 1 – изопропилового спирта; 2 – бутилового спирта; 3 – гексилового спирта |
Гmax(С6Н13ОН)=Гmax(С4Н9ОН)= Гmax(С3Н7ОН)
но эти значения предельных адсорбций достигаются при разных концентрациях с (С6Н13ОН) < c (С4Н9ОН) < c (С3Н7ОН).
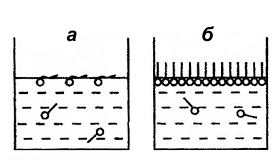
То, что Гi во всех случаях стремится к Гmax, можно объяснить тем, что адсорбция является мономолекулярной. Тот факт, что предельная адсорбция внутри гомологического ряда не зависит от длины углеводородного радикала можно объяснить строго определенным расположением молекул в поверхностном слое, которое представлено на рис.11.
|
Рис.11. Ориентация молекул ПАВ на поверхности водный раствор-газ: а – в разбавленных растворах; б – в концентрированных растворах |
Предельная избыточная адсорбция ПАВ равна:
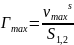 ,
,
где
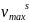 – количество ПАВ в насыщенном поверхностном
слое;
– количество ПАВ в насыщенном поверхностном
слое;
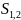 ,
м2
– площадь межфазной поверхности.
,
м2
– площадь межфазной поверхности.
Так как поверхность полностью заполнена молекулами ПАВ, то:
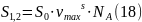
где S0, м2 – площадь поперечного сечения одной молекулы, NA = 6,02·1023 молекул – постоянная Авогадро.
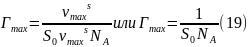
Зависимость величины адсорбции ПАВ от концентрации раствора Г=f(c) хорошо описывается уравнением Ленгмюра:
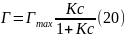
где
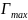 ,
моль/м2
– константа, значение которой соответствует
максимальной адсорбции ПАВ поверхностным
слоем; K, м3/моль
– константа, величина которой зависит
от длины углеводородного радикала
молекулы ПАВ (при увеличении длины цепи
на 1 группу (-СН2-)
К увеличивается в 3 – 3,5 раза); Г, моль/м2
– равновесная избыточная адсорбция
ПАВ из раствора с концентрацией c,
моль/дм3.
,
моль/м2
– константа, значение которой соответствует
максимальной адсорбции ПАВ поверхностным
слоем; K, м3/моль
– константа, величина которой зависит
от длины углеводородного радикала
молекулы ПАВ (при увеличении длины цепи
на 1 группу (-СН2-)
К увеличивается в 3 – 3,5 раза); Г, моль/м2
– равновесная избыточная адсорбция
ПАВ из раствора с концентрацией c,
моль/дм3.
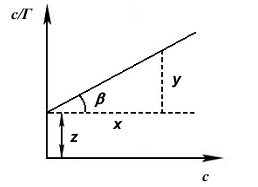
Константы и К в уравнении Ленгмюра определяют графически, приводя это уравнение к линейному виду. Для этого правую и левую части уравнения надо «перевернуть»:
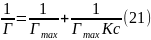
Умножим обе части уравнения (21) на с:
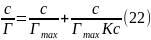
На рис. 12 показан график c/Г = f(c). Тангенс угла наклона β прямой к оси абсцисс имеет вид:
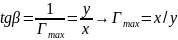
Отрезок, отсекаемый прямой на оси ординат описывается формулами:
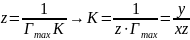
|
Рис.12. Зависимость с/Г от с. |
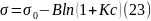
где – поверхностное натяжение растворителя; – поверхностное натяжение раствора; В, Дж/м2 – константа для данного гомологического ряда, не зависящая от длины углеводородного радикала.