
- •8. Молекулярно – кинетическая теория строения вещества
- •8.1. Молекулярно-кинетическая теория
- •8.2. Модель идеального газа. Основное уравнение состояния идеального газа
- •8.3. Основное уравнение кинетической теории газов
- •8.4. Молекулярно-кинетическая трактовка абсолютной температуры
- •8.5.Основные газовые законы молекулярно кинетической теории
- •8.5.1. Закон Бойля-Мариотта
- •8.5.2. Закон Гей-Люссака
- •8.5.3. Закон Шарля
- •8.5.4. Объединенный газовый закон Мариотта-Гей-Люссака
- •8.5.4. Закон Дальтона
- •9. Некоторые вопросы статистической физики
- •9.1. Распределение энергии по степеням свободы Число степеней свободы молекулы. Теорема Больцмана
- •9.2. Вероятность и флюктуации. Скорости теплового движения частиц
- •9.3. Распределение молекул (частиц) по скоростям.
- •Средняя длина свободного пробега молекул
- •9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •9.5.Средняя длина свободного пробега молекул
- •9.6. Распределение Больцмана. Барометрическая формула
- •Внутренняя энергия. Первое начало термодинамики
- •9.8. Теплоёмкость газа. Уравнение Роберта Майера. Классическая теория теплоёмкостей
- •10. Элементы термодинамики
- •10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
- •10.1.1. Изохорный процесс
- •10.1.2. Изобарный процесс
- •10.1.3. Изотермический процесс
- •10.1.4. Адиабатический процесс
- •1 0.1.5. Работа и теплоёмкость при адиабатном процессе.
- •10.2. Основное уравнение термодинамики идеального газа. Энтропия.
- •10.3. Обратимые, необратимые и круговые процессы (циклы)
- •10.4. Цикл Карно. Максимальный кпд тепловой машины
- •10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
- •10.6. Второе начало термодинамики
- •10.7. Третье начало термодинамики (теорема Нернста)
- •11. Реальные газы
- •11.1. Реальные газы. Молекулярные силы
- •11.2.Уравнение Ван-дер-Ваальса
- •11.3. Изотермы Ван-дер-Ваальса
- •12.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •13. Элементы механики сплошных сред
- •13.1. Строение жидкостей
- •13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •13.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •13.4. Давление под искривлённой поверхностью жидкости. Формула Лапласа
- •13.5. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •13.6. Капиллярные явления. Закон Жюрена
- •13.7. Жидкие кристаллы, их строение и свойства
- •13.8. Магнитные жидкости
- •1 3.8.1. Структура магнитных жидкостей
- •13.8.2. Получение магнитных жидкостей
- •13.8.3. Свойства магнитных жидкостей
- •13.8.4. Применение магнитных жидкостей
- •13.9. Кристаллическое состояние
- •13.9.1. Отличительные черты кристаллического состояния
- •13.9.2 Физические типы кристаллических решеток
10. Элементы термодинамики
10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
Изопроцессы – равновесные процессы, в которых один из основных параметров сохраняется постоянным.
10.1.1. Изохорный процесс
И зохорический
процесс - протекает при постоянном
объеме (V = const),
т.е. dV
= 0. Диаграмма – изохора представлена
на рис.10.1. Процесс 12
– изохорное нагревание; процесс 21
– изохорное охлаждение.
зохорический
процесс - протекает при постоянном
объеме (V = const),
т.е. dV
= 0. Диаграмма – изохора представлена
на рис.10.1. Процесс 12
– изохорное нагревание; процесс 21
– изохорное охлаждение.
Запишем первое начало термодинамики:
![]() .
.
Так как
![]() ,
то при изохорическом процессе, все
подводимое к системе тепло идет на
изменение ее внутренней энергии.
,
то при изохорическом процессе, все
подводимое к системе тепло идет на
изменение ее внутренней энергии.
![]() .
.
При этом (для 1
моля):
![]()
![]()
следовательно
![]() - изменение внутренней энергии системы
пропорционально изменению ее температуры.
- изменение внутренней энергии системы
пропорционально изменению ее температуры.
Для
произвольной массы газа:
![]()
10.1.2. Изобарный процесс
Изобарический процесс протекает при постоянном давлении (p = const). Диаграмма – изобара (рис.10.2). Процесс 12 – изобарное расширение при росте температуры; процесс 21 – изобарное сжатие при уменьшении Т.
Для изобарного процесса:
![]()
т.е. подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы.
При изобарном расширении объёма от V1 до V2 работа газа:

и определяется площадью прямоугольника (рис.10.1).
Используя уравнение Менделеева – Клапейрона для выбранных нами двух состояний, запишем:
![]() и
и
![]() ,
откуда:
,
откуда:
![]() .
.
Тогда работу изобарного расширения можно найти:
![]() (1)
(1)
Т.о., в изобарном процессе при сообщении газу массой m количества теплоты:
![]()
его внутренняя
энергия увеличится на величину:
![]() ,
,
газ при этом совершит работу (1).
10.1.3. Изотермический процесс
Изотермический процесс. Это процесс, протекающий при постоянной температуре (T = const). Тогда

При изотермическом расширении давление не остается постоянным. Оно убывает по мере увеличения объема (рис.10.3). Поэтому для подсчета работы в данном случае нельзя пользоваться простой формулой А = РV.
В данном случае необходимо весь интервал давлений от V1 до V2 разбить на бесконечно малые приращения dV. В пределах столь малых изменений объема давление будет практически оставаться постоянным (P).
Для элементарной работы dA можно записать dА = РdV.
Из уравнения Менделеева – Клапейрона выразим давление:
![]() ,
тогда элементарная работа:
,
тогда элементарная работа:
![]() .
.
Вся работа:
 ,
,
![]() .
.
При изотермическом расширении dU = CvdT = 0, т.е. U = const, т.е. все подводимое к системе тепло идет на совершение этой системой работы:
![]()
![]() .
.
Согласно определению теплоемкости
![]() .
.
Бесконечная теплоемкость не является абсурдом. Она означает, что все подводимое тело идет на совершение работы и не приводит к повышению температуры. Причем, если тепло подводится к телу, т.е.
Q > 0, то С = +, если же происходит изотермическое сжатие, то Q < 0 и С = -.
10.1.4. Адиабатический процесс
Уравнения Пуассона
Процессы, протекающие без теплообмена или почти без теплообмена с окружающей средой называют адиабатическими или адиабатными. Примером адиабатического процесса может служить быстро протекающий процесс сжатия или расширения газа. При адиабатном процессе одновременно меняются все три параметра состояния: Р, V, T. В соответствии с этим для адиабатного процесса имеются три уравнения, связывающие попарно указанные параметры: V и Т, Р и V, Р и Т.
Найдем зависимость
между давлением и объемом при адиабатическом
процессе, для чего воспользуемся первым
началом термодинамики
.
Так как
![]() ,
то
,
то
![]() ,
а
,
а
![]() ,
,
т.е. работа,
совершаемая системой при адиабатическом
процессе, сопровождается изменением
ее внутренней энергии. Но,
![]() а
а
![]() ,
тогда
,
тогда
![]() .
.
Из уравнения
состояния идеального газа для моля или
киломоля
![]() ,
следовательно
,
следовательно
![]() или
или
![]() откуда,
откуда,
![]() т.е.
т.е.
![]() ,
а
,
а
![]() .
.
Известно, что
![]() ,
а
,
а
![]() ,
тогда
,
тогда
![]() ;
;
![]()
или
![]() (1)
(1)
Следовательно, при адиабатических процессах произведение температуры на объем в степени ( - 1 ) для данной массы остается величиной постоянной.
Из полученного видно, что при адиабатическом расширении идеального газа его температура уменьшается, а при адиабатическом сжатии - увеличивается.
(1)– первое
уравнение Пуассона,
здесь
![]() ,
(т.к.
,
)
,
(т.к.
,
)
Из уравнения
Менделеева - Клапейрона для моля или
киломоля идеального газа
![]() .
Подставляя значения T
и V
в уравнение (1), имеем
.
Подставляя значения T
и V
в уравнение (1), имеем
![]() (2)
(2)
![]()
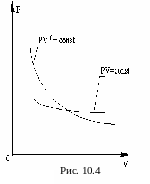
Уравнение (2) – второе уравнение Пуассона или уравнение адиабаты. Графически (в координатах p, V) адиабатический процесс можно представить адиабатой. При этом адиабата располагается более круто, чем изотерма (т.к. 1) (рис. 10.4). Это объясняется тем, что при изотермическом сжатии давление возрастает за счет изменения молекулярной плотности, т.е. за счет увеличения числа ударов молекул о стенки сосуда. При адиабатическом процессе сжатие сопровождается повышением температуры, т.е. давление возрастает не только за счет увеличения молекулярной плотности, но и за счет роста средней скорости движения молекул.
