
- •8. Молекулярно – кинетическая теория строения вещества
- •8.1. Молекулярно-кинетическая теория
- •8.2. Модель идеального газа. Основное уравнение состояния идеального газа
- •8.3. Основное уравнение кинетической теории газов
- •8.4. Молекулярно-кинетическая трактовка абсолютной температуры
- •8.5.Основные газовые законы молекулярно кинетической теории
- •8.5.1. Закон Бойля-Мариотта
- •8.5.2. Закон Гей-Люссака
- •8.5.3. Закон Шарля
- •8.5.4. Объединенный газовый закон Мариотта-Гей-Люссака
- •8.5.4. Закон Дальтона
- •9. Некоторые вопросы статистической физики
- •9.1. Распределение энергии по степеням свободы Число степеней свободы молекулы. Теорема Больцмана
- •9.2. Вероятность и флюктуации. Скорости теплового движения частиц
- •9.3. Распределение молекул (частиц) по скоростям.
- •Средняя длина свободного пробега молекул
- •9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •9.5.Средняя длина свободного пробега молекул
- •9.6. Распределение Больцмана. Барометрическая формула
- •Внутренняя энергия. Первое начало термодинамики
- •9.8. Теплоёмкость газа. Уравнение Роберта Майера. Классическая теория теплоёмкостей
- •10. Элементы термодинамики
- •10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
- •10.1.1. Изохорный процесс
- •10.1.2. Изобарный процесс
- •10.1.3. Изотермический процесс
- •10.1.4. Адиабатический процесс
- •1 0.1.5. Работа и теплоёмкость при адиабатном процессе.
- •10.2. Основное уравнение термодинамики идеального газа. Энтропия.
- •10.3. Обратимые, необратимые и круговые процессы (циклы)
- •10.4. Цикл Карно. Максимальный кпд тепловой машины
- •10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
- •10.6. Второе начало термодинамики
- •10.7. Третье начало термодинамики (теорема Нернста)
- •11. Реальные газы
- •11.1. Реальные газы. Молекулярные силы
- •11.2.Уравнение Ван-дер-Ваальса
- •11.3. Изотермы Ван-дер-Ваальса
- •12.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •13. Элементы механики сплошных сред
- •13.1. Строение жидкостей
- •13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •13.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •13.4. Давление под искривлённой поверхностью жидкости. Формула Лапласа
- •13.5. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •13.6. Капиллярные явления. Закон Жюрена
- •13.7. Жидкие кристаллы, их строение и свойства
- •13.8. Магнитные жидкости
- •1 3.8.1. Структура магнитных жидкостей
- •13.8.2. Получение магнитных жидкостей
- •13.8.3. Свойства магнитных жидкостей
- •13.8.4. Применение магнитных жидкостей
- •13.9. Кристаллическое состояние
- •13.9.1. Отличительные черты кристаллического состояния
- •13.9.2 Физические типы кристаллических решеток
9.6. Распределение Больцмана. Барометрическая формула
Из уравнения
Менделеева – Клапейрона:
![]() или
или
![]()
Откуда следует, в частности, что плотность воздуха уменьшается с высотой.
![]()
Выведем формулу зависимости атмосферного давления P от высоты (над уровнем моря) столба воздуха h, получившей название барометрической формулы.
И в данном случае в основу расчета будет положена некая абстракция - модель атмосферы, которая является лишь приближением к реальной атмосфере. Суть модели сводиться к следующим трем условиям:
(g = const) что достаточно обосновано лишь до высот около 100 км/;
температура вдоль столба воздуха остается постоянной т.е. рассматривается "изотермическая" атмосфера;
воздух состоит из молекул одного сорта (например, N2 )
Поскольку плотность газа не остается постоянной с высотой столба, то в данном случае неприменима известная формула для давления жидкости на стенки сосуда: P=gh.
Поэтому воспользуемся таким приемом: мысленно разобьем толщу атмосферы на тонкие плоские слои воздуха (см. рис.9.6). Каждый такой слой настолько тонок, что плотность воздуха в нем остается постоянной, и вместе с тем газ, заключенный в нем, можно рассматривать как сплошную среду. Тогда приращение давления
d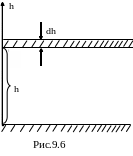 p
=-gdh
p
=-gdh
Знак
"-"
указывает на то, что с высотой убывает
давление. Поскольку на разных высотах
различно, воспользуемся
полученной формулой
![]() ,
что позволяет записать:
,
что позволяет записать:
dP
=![]() или
или
![]() (1)
(1)
Проинтегрируем обе части этого равенства (беря неопределенный интеграл):
![]() или
или
![]() .
.
Если h = 0, то Р = Ро, поэтому: C = P0 и
![]() (2)
(2)
М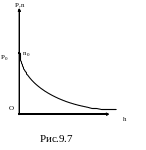 ы
получили барометрическую формулу;
графическая зависимость представлена
на рис.9.7.
ы
получили барометрическую формулу;
графическая зависимость представлена
на рис.9.7.
Учитывая, что n p находим:
![]() (3)
(3)
(3) —распределение Больцмана
Т.е. концентрация молекул с высотой столба убывает по экспоненциальному закону.
На основе зависимостей (2) и (3) разработаны простые приборы для определения высоты над уровнем моря -альтиметры. Знаменитый физик Гельмгольц еще в начале века путешествуя по Альпам останавливался и кипятил воду, чтобы по температуре кипения определить давление и по барометрической формуле рассчитать высоту гор, на которую он забрался.
Внутренняя энергия. Первое начало термодинамики
Внутренняя энергия тела U складывается из кинетической энергии поступательного и вращательного движения отдельных молекул этого тела, и потенциальной энергии их взаимного расположения, т.е.
U = Eк + EкBP+Eп
В одном киломоле любого газа содержится NА молекул (NА - число Авогадро). Следовательно, один киломоль идеального газа имеет внутреннюю энергию, равную
![]()
Для идеального
газа
![]()
Внутренняя энергия произвольной массы газа m
![]()
где - молярная масса газа.
Таким образом, внутренняя энергия идеального газа зависит только от его объёма и давления.
Внутренняя энергия может изменяться за счет двух различных процессов: совершения над телом работы и сообщения ему количества тепла. Если при сообщении газу тепла Q он совершает над окружающими телами работу A и, кроме того, происходит приращение его внутренней энергии U, то закон сохранения энергии (в термодинамике) обуславливает равенство:
Q = U + A (2)
Это равенство носит название 1го начала термодинамики. Следует заметить, что внутренняя энергия является однозначной функцией состояния системы частиц, т.е. определяется тройкой параметров Т, Р , V и не зависит от характера и последовательности процессов. Соответственно dU - это полный дифференциал.
Q и A не являются полным дифференциалом, их величина зависит от характера процессов, сопровождающих переход из начального состояния в конечное.
