
- •8. Молекулярно – кинетическая теория строения вещества
- •8.1. Молекулярно-кинетическая теория
- •8.2. Модель идеального газа. Основное уравнение состояния идеального газа
- •8.3. Основное уравнение кинетической теории газов
- •8.4. Молекулярно-кинетическая трактовка абсолютной температуры
- •8.5.Основные газовые законы молекулярно кинетической теории
- •8.5.1. Закон Бойля-Мариотта
- •8.5.2. Закон Гей-Люссака
- •8.5.3. Закон Шарля
- •8.5.4. Объединенный газовый закон Мариотта-Гей-Люссака
- •8.5.4. Закон Дальтона
- •9. Некоторые вопросы статистической физики
- •9.1. Распределение энергии по степеням свободы Число степеней свободы молекулы. Теорема Больцмана
- •9.2. Вероятность и флюктуации. Скорости теплового движения частиц
- •9.3. Распределение молекул (частиц) по скоростям.
- •Средняя длина свободного пробега молекул
- •9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •9.5.Средняя длина свободного пробега молекул
- •9.6. Распределение Больцмана. Барометрическая формула
- •Внутренняя энергия. Первое начало термодинамики
- •9.8. Теплоёмкость газа. Уравнение Роберта Майера. Классическая теория теплоёмкостей
- •10. Элементы термодинамики
- •10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
- •10.1.1. Изохорный процесс
- •10.1.2. Изобарный процесс
- •10.1.3. Изотермический процесс
- •10.1.4. Адиабатический процесс
- •1 0.1.5. Работа и теплоёмкость при адиабатном процессе.
- •10.2. Основное уравнение термодинамики идеального газа. Энтропия.
- •10.3. Обратимые, необратимые и круговые процессы (циклы)
- •10.4. Цикл Карно. Максимальный кпд тепловой машины
- •10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
- •10.6. Второе начало термодинамики
- •10.7. Третье начало термодинамики (теорема Нернста)
- •11. Реальные газы
- •11.1. Реальные газы. Молекулярные силы
- •11.2.Уравнение Ван-дер-Ваальса
- •11.3. Изотермы Ван-дер-Ваальса
- •12.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •13. Элементы механики сплошных сред
- •13.1. Строение жидкостей
- •13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •13.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •13.4. Давление под искривлённой поверхностью жидкости. Формула Лапласа
- •13.5. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •13.6. Капиллярные явления. Закон Жюрена
- •13.7. Жидкие кристаллы, их строение и свойства
- •13.8. Магнитные жидкости
- •1 3.8.1. Структура магнитных жидкостей
- •13.8.2. Получение магнитных жидкостей
- •13.8.3. Свойства магнитных жидкостей
- •13.8.4. Применение магнитных жидкостей
- •13.9. Кристаллическое состояние
- •13.9.1. Отличительные черты кристаллического состояния
- •13.9.2 Физические типы кристаллических решеток
9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
В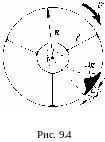 1920 г. Штерн поставил опыт, с помощью
которого можно было непосредственно
проверить теорию распределения молекул
по скоростям и измерить скорость
теплового движения молекул. Суть опыта
поясняется на рис.9.4.
1920 г. Штерн поставил опыт, с помощью
которого можно было непосредственно
проверить теорию распределения молекул
по скоростям и измерить скорость
теплового движения молекул. Суть опыта
поясняется на рис.9.4.
Два коаксиальных цилиндра вращаются как единое целое с угловой скоростью . По оси натянута платиновая проволока, покрытая тонким слоем серебра. Провод нагревается электрическим током. Температура проводки измеряется по ее электрическому сопротивлению. При температуре t = 12000С атомы серебра испаряются и разлетаются по всем направлениям. Через узкую щель, прорезанную во внутреннем цилиндре, вылетает пучок атомов серебра, скорость которых направлена вдоль радиусов.
Пока атом, летящий
со скоростью v,
проходит расстояние между цилиндрами
l,
цилиндры успевают повернуться на угол
,
![]() ,
но
,
но
![]() ,
следовательно,
,
следовательно,
![]() ,
при l
R.
,
при l
R.
Откуда
![]() ,
,
где S – расстояние по окружности внешнего цилиндра от конца радиуса, проведенного через отверстие (через границу щели).
Вычисленные по результатам эксперимента значения скорости оказались близки к теоретическим результатам; кроме того, профиль сечения слоя серебра, как показано на рисунке, весьма точно соответствует распределению Максвелла молекул по скоростям. Теория получила хорошее подтверждение на опыте.
9.5.Средняя длина свободного пробега молекул
Молекулы газа,
находясь в тепловом движении, непрерывно
сталкиваются друг с другом. Минимальное
расстояние, на которое сближаются при
столкновении центры двух молекул,
называется эффективным
диаметром молекулы
d.
Эффективный диаметр несколько уменьшается
при увеличении скорости молекул, т. е.
с повышением температуры. Величина
![]() называется эффективным
сечением молекулы.
называется эффективным
сечением молекулы.
Средний путь, проходимый молекулой между двумя последовательными столкновениями, называется средней длиной свободного пробега .
За 1 с молекула
проходит в среднем путь, равный средней
скорости
![]() .
Если за 1 с в среднем происходит
.
Если за 1 с в среднем происходит
![]() столкновений,
то средняя длина пробега
столкновений,
то средняя длина пробега
![]() .
(1)
.
(1)
П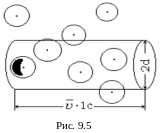 редположим,
что все молекулы, кроме данной молекулы,
застыли неподвижно на своих местах
(рис. 9.5).
редположим,
что все молекулы, кроме данной молекулы,
застыли неподвижно на своих местах
(рис. 9.5).
Столкновение
происходит в том случае, если центр
молекулы, с которой сталкивается данная
молекула, лежит внутри цилиндра радиуса
d. За
1с данная молекула столкнется с
неподвижными молекулами столько раз,
сколько находится внутри такого цилиндра
длиной l
= │v│∙1
c.
Объем этого цилиндра составляет V
=
![]() ;
;
число молекул,
заключенных в нем
![]() (n – концентрация), следовательно, число
столкновений одной молекулы с неподвижными
молекулами за 1с:
(n – концентрация), следовательно, число
столкновений одной молекулы с неподвижными
молекулами за 1с:
![]() .
.
В действительности
все молекулы движутся, вследствие чего
число соударений определяется средней
скоростью движения молекул по отношению
друг к другу. Как показывает расчет,
средняя скорость относительного движения
молекул в
![]() раз больше
(относительно
стенок сосуда). Поэтому
раз больше
(относительно
стенок сосуда). Поэтому
![]() (2)
(2)
Подставляя (2) в (1), получим
![]() или
или
![]() .
.
Поскольку, при постоянной температуре, n изменяется пропорционально p (p = n∙k∙T), то
![]()
Так, например, при нормальных условиях n = 2,681025 м-3, эффективный диаметр молекулы d ~1 Å = 10-10 м, поэтому длина свободного пробега 0 = 210-7 м, а при давлении 0,1 Па 0,10 м.
