
- •8. Молекулярно – кинетическая теория строения вещества
- •8.1. Молекулярно-кинетическая теория
- •8.2. Модель идеального газа. Основное уравнение состояния идеального газа
- •8.3. Основное уравнение кинетической теории газов
- •8.4. Молекулярно-кинетическая трактовка абсолютной температуры
- •8.5.Основные газовые законы молекулярно кинетической теории
- •8.5.1. Закон Бойля-Мариотта
- •8.5.2. Закон Гей-Люссака
- •8.5.3. Закон Шарля
- •8.5.4. Объединенный газовый закон Мариотта-Гей-Люссака
- •8.5.4. Закон Дальтона
- •9. Некоторые вопросы статистической физики
- •9.1. Распределение энергии по степеням свободы Число степеней свободы молекулы. Теорема Больцмана
- •9.2. Вероятность и флюктуации. Скорости теплового движения частиц
- •9.3. Распределение молекул (частиц) по скоростям.
- •Средняя длина свободного пробега молекул
- •9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •9.5.Средняя длина свободного пробега молекул
- •9.6. Распределение Больцмана. Барометрическая формула
- •Внутренняя энергия. Первое начало термодинамики
- •9.8. Теплоёмкость газа. Уравнение Роберта Майера. Классическая теория теплоёмкостей
- •10. Элементы термодинамики
- •10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
- •10.1.1. Изохорный процесс
- •10.1.2. Изобарный процесс
- •10.1.3. Изотермический процесс
- •10.1.4. Адиабатический процесс
- •1 0.1.5. Работа и теплоёмкость при адиабатном процессе.
- •10.2. Основное уравнение термодинамики идеального газа. Энтропия.
- •10.3. Обратимые, необратимые и круговые процессы (циклы)
- •10.4. Цикл Карно. Максимальный кпд тепловой машины
- •10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
- •10.6. Второе начало термодинамики
- •10.7. Третье начало термодинамики (теорема Нернста)
- •11. Реальные газы
- •11.1. Реальные газы. Молекулярные силы
- •11.2.Уравнение Ван-дер-Ваальса
- •11.3. Изотермы Ван-дер-Ваальса
- •12.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •13. Элементы механики сплошных сред
- •13.1. Строение жидкостей
- •13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •13.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •13.4. Давление под искривлённой поверхностью жидкости. Формула Лапласа
- •13.5. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •13.6. Капиллярные явления. Закон Жюрена
- •13.7. Жидкие кристаллы, их строение и свойства
- •13.8. Магнитные жидкости
- •1 3.8.1. Структура магнитных жидкостей
- •13.8.2. Получение магнитных жидкостей
- •13.8.3. Свойства магнитных жидкостей
- •13.8.4. Применение магнитных жидкостей
- •13.9. Кристаллическое состояние
- •13.9.1. Отличительные черты кристаллического состояния
- •13.9.2 Физические типы кристаллических решеток
8.4. Молекулярно-кинетическая трактовка абсолютной температуры
Для одного киломоля идеального газа можно записать:
(1)
Р
=![]() ,
(2)
,
(2)
где
![]() - суммарная кинетическая энергия
поступательного движения всех молекул
газа (одного моля), m
–масса газа,
- суммарная кинетическая энергия
поступательного движения всех молекул
газа (одного моля), m
–масса газа,
![]() -
средняя квадратичная скорость
поступательного движения молекул.
Средняя квадратичная скорость:
-
средняя квадратичная скорость
поступательного движения молекул.
Средняя квадратичная скорость:
![]() ,
,
![]() - скорости молекул,
N
– число молекул.
- скорости молекул,
N
– число молекул.
Из (1) и (2) следует:
RT=
. Преобразуем это выражение:
![]() .
.
Так как
![]() - постоянная Больцмана, а
- постоянная Больцмана, а
![]() =
=
![]() - средняя кинетическая энергия
поступательного движения одной молекулы
газа, то
:
- средняя кинетическая энергия
поступательного движения одной молекулы
газа, то
:
![]() .
(3)
.
(3)
Из (3) следует:
![]() - абсолютная температура T
лишь постоянным множителем
- абсолютная температура T
лишь постоянным множителем
![]() отличается от
отличается от
![]()
Следовательно, мерой абсолютной температуры является средняя кинетическая энергия поступательного движения молекул идеального газа. Вытекающий из классической физики вывод: абсолютный нуль (-273,15 0С) - температура, при которой поступательное движение молекул идеального газа замирает.
8.5.Основные газовые законы молекулярно кинетической теории
Ещё до появления молекулярно-кинетической теории газов был экспериментально установлен целый ряд законов, описывающих поведение идеальных газов.
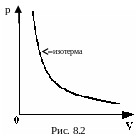
8.5.1. Закон Бойля-Мариотта
«Для данной массы газа при неизменной температуре произведение его давления на объем величина постоянная»:
pV = const при Т = const
В термодинамике процесс, происходящий при постоянной температуре, называется изотермическим. Графически он изображается в координатах p, V изотермой (рис. 8.2).
8.5.2. Закон Гей-Люссака
![]() ,
(1)
,
(1)
т.е. для данной массы газа при постоянном давлении их объемы относятся как абсолютные температуры. Или «Для данной массы газа при постоянном давлении отношение объема к абсолютной температуре остается величиной постоянной»:
![]() .
(2)
.
(2)
Формулы (1) и (2) отображают закон Гей-Люссака.
В термодинамике процесс, происходящий при постоянном давлении, называется изобарическим.
Экспериментально установлено, что в этом случае объем газа изменяется по закону (при m = const, p = const)
Vt = V0(1 + t),
г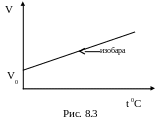 де
- коэффициент объёмного расширения -
величина, которая показывает, как
изменилась каждая единица начального
объёма газа (при 0 0С)
от нагревания его на один градус при
постоянном давлении
де
- коэффициент объёмного расширения -
величина, которая показывает, как
изменилась каждая единица начального
объёма газа (при 0 0С)
от нагревания его на один градус при
постоянном давлении
![]() .
.
Такой процесс в координатах V, t он изображается изобарой (рис. 8.3).
8.5.3. Закон Шарля
![]() ,
(1)
,
(1)
т.е. для данной массы газа при постоянном объеме их давления относятся как абсолютные температуры. Или: «Для данной массы газа при постоянном объеме отношение давления к абсолютной температуре остается величиной постоянной»
![]() .
(2)
.
(2)
Формулы (1) и (2) отображают закон Шарля.
В термодинамике процесс, происходящий при постоянном объеме, называется изохорическим.
Давление данной массы газа при изохорическом процессе изменяется по закону (при m = const, V = const)
![]() ,
,
где - термический коэффициент давления, который показывает, на какую часть изменилась каждая единица начального давления газа (при 0 0С) от нагревания его на один градус при постоянном объёме
![]()
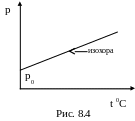 .
.
Графически в координатах p, t такой процесс изображается изохорой (рис.8.4).
Так как = , то все изобары и изохоры пересекают ось "t" в одной и той же точке. Если начало отсчёта температур сместить в эту точку, то мы перейдём к другой температурной шкале - шкале Кельвина (абсолютной шкале температур). При этом между температурой по шкале Кельвина и температурой по шкале Цельсия существует связь
T = t + 273,15.
