
- •8. Молекулярно – кинетическая теория строения вещества
- •8.1. Молекулярно-кинетическая теория
- •8.2. Модель идеального газа. Основное уравнение состояния идеального газа
- •8.3. Основное уравнение кинетической теории газов
- •8.4. Молекулярно-кинетическая трактовка абсолютной температуры
- •8.5.Основные газовые законы молекулярно кинетической теории
- •8.5.1. Закон Бойля-Мариотта
- •8.5.2. Закон Гей-Люссака
- •8.5.3. Закон Шарля
- •8.5.4. Объединенный газовый закон Мариотта-Гей-Люссака
- •8.5.4. Закон Дальтона
- •9. Некоторые вопросы статистической физики
- •9.1. Распределение энергии по степеням свободы Число степеней свободы молекулы. Теорема Больцмана
- •9.2. Вероятность и флюктуации. Скорости теплового движения частиц
- •9.3. Распределение молекул (частиц) по скоростям.
- •Средняя длина свободного пробега молекул
- •9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •9.5.Средняя длина свободного пробега молекул
- •9.6. Распределение Больцмана. Барометрическая формула
- •Внутренняя энергия. Первое начало термодинамики
- •9.8. Теплоёмкость газа. Уравнение Роберта Майера. Классическая теория теплоёмкостей
- •10. Элементы термодинамики
- •10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
- •10.1.1. Изохорный процесс
- •10.1.2. Изобарный процесс
- •10.1.3. Изотермический процесс
- •10.1.4. Адиабатический процесс
- •1 0.1.5. Работа и теплоёмкость при адиабатном процессе.
- •10.2. Основное уравнение термодинамики идеального газа. Энтропия.
- •10.3. Обратимые, необратимые и круговые процессы (циклы)
- •10.4. Цикл Карно. Максимальный кпд тепловой машины
- •10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
- •10.6. Второе начало термодинамики
- •10.7. Третье начало термодинамики (теорема Нернста)
- •11. Реальные газы
- •11.1. Реальные газы. Молекулярные силы
- •11.2.Уравнение Ван-дер-Ваальса
- •11.3. Изотермы Ван-дер-Ваальса
- •12.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •13. Элементы механики сплошных сред
- •13.1. Строение жидкостей
- •13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •13.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •13.4. Давление под искривлённой поверхностью жидкости. Формула Лапласа
- •13.5. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •13.6. Капиллярные явления. Закон Жюрена
- •13.7. Жидкие кристаллы, их строение и свойства
- •13.8. Магнитные жидкости
- •1 3.8.1. Структура магнитных жидкостей
- •13.8.2. Получение магнитных жидкостей
- •13.8.3. Свойства магнитных жидкостей
- •13.8.4. Применение магнитных жидкостей
- •13.9. Кристаллическое состояние
- •13.9.1. Отличительные черты кристаллического состояния
- •13.9.2 Физические типы кристаллических решеток
13. Элементы механики сплошных сред
13.1. Строение жидкостей
Жидкость – агрегатное состояние вещества, промежуточное между газообразным и твёрдым.
Подобно газам жидкости принимают форму сосуда, в котором находятся, подобно твёрдым телам обладают определённым объёмом. Такие свойства жидкостей обусловлены особенностями их строения.
В газах нет никакого порядка в расположении молекул, они движутся хаотично. Молекулы газов почти не связаны между собой межмолекулярными силами. Их средняя кинетическая энергия теплового движения гораздо больше средней потенциальной энергии, обусловленной силами взаимодействия между ними. Поэтому молекулы газа совершают относительно большие пробеги, "разлетаясь" друг от друга на расстояния, зависящие от размеров сосуда, занимая весь его объем. Данное утверждение подтверждается довольно быстро протекающей в газах диффузией.
В твёрдых телах наблюдается дальний порядок в расположении частиц (т.е. упорядоченное расположение, повторяющееся на больших расстояниях). В твердых телах силы взаимодействия между молекулами (атомами, ионами) играют существенную роль, удерживают их на определенных расстояниях. Средняя потенциальная энергия, обусловленная данными силами, больше средней кинетической энергии теплового движения.
В жидкостях есть ближний порядок в расположении частиц. Рентгеноструктурные исследования жидкостей показали, что их внутреннее строение имеет много общего со строением твердых тел, состоящих из большого числа, малых по размеру, кристаллов с беспорядочным расположением осей. Однако "элементарные кристаллики", непрерывно образующиеся и разрушающиеся внутри жидкости, имеют незначительные размеры и могут перемещаться в пределах объема, занимающего жидкостью.
Теорию жидкого состояния разработал советский физик-теоретик Яков Ильич Френкель. Тепловое движение молекул жидкости он объяснял так.
Молекулы жидкостей не совершают больших пробегов, совершают колебательные движения относительно некоторого положения равновесия. Иногда, вследствие благоприятной комбинации столкновений, молекула жидкости может перейти на новое местоположение, на расстояние, сравнимое с размерами самой молекулы (это подтверждается значительно медленнее протекающей в них диффузией). Эти перескоки носят хаотический, «газовый характер».
13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
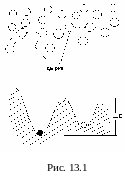
На рис.13.1 поясняется особенность строения жидкостей. Чтобы молекуле оказаться на новом месте, ей приходиться «протиснуться» между двумя соседями, образующими «узкий коридор». Френкель предложил математическую интерпретацию такого перехода: вероятность того, что молекула перейдет в новое положение равновесия зависит от соотношения тепловой энергии kT и высоты потенциального барьера ∆Е, который приходится преодолеть, чтобы оказаться в свободном месте. Вероятность перехода w по Френкелю пропорциональна экспоненте в степени -∆Е/kT
![]()
![]() .
(1)
.
(1)
При этом время оседлой жизни обратно пропорционально w.
Одним из свойств жидкостей является вязкость, которая определяется их молекулярным составом и строением. Она аналогична внутреннему трению в газах и относится к явлениям переноса в жидкой среде. Оценивается вязкость жидкостей по коэффициенту вязкости, который определяет величину силы трения между соседними ее слоями
![]() ,
(2)
,
(2)
где dv/dz - градиент скорости в направлении z;
S – поверхность соприкасающихся слоев жидкости.
Физический смысл коэффициента вязкости - он численно равен силе внутреннего трения, возникающей между двумя слоями жидкости при S = 1 и градиенте скорости равном единице.
В отличие от коэффициента вязкости в газах, который уменьшается с уменьшением температуры T, коэффициент вязкости жидкостей возрастает с уменьшением их температуры, что вытекает из теории Френкеля
![]() (3)
(3)
где U - энергия необходимая для перехода молекулы жидкости из одного равновесного состояния в другое.
Таким образом, с повышением температуры жидкости ее вязкость убывает по экспоненте. Этот вывод теории хорошо подтверждается на опыте. Противоположный характер температурной зависимости вязкости газов и жидкостей обусловлен принципиальным различием механизмов вязкости. В газах вязкость объясняется переносом импульса частицами из слоя в слой за счет хаотического теплового движения частиц. При этом интенсивность переноса импульса увеличивается с температурой. В жидкостях вязкость обусловлена преодолением потенциального барьера молекулой при переходе в новое положение равновесия (дырку), которое осуществляется тем легче, чем больше тепловая энергия молекулы kT и чем ниже высота барьера ∆Е. С уменьшением Т переход молекулы в соседнюю дырку затрудняется, вязкость возрастает.
Текучесть жидкостей свойство обратное вязкости, которое обусловлено той свободой движения молекул в объеме, которая еще допускается силами сцепления между ними.
Известно, что молекулы жидкости не связаны между собой "жестко"; каждая молекула, совершая беспорядочное движение, может изменять свое местоположение относительно "соседей" и стечением времени перемещается в объеме сосуда. Если время действия внешних сил, приложенных к жидкости, меньше, чем время "оседлой жизни" молекулы, то для того, чтобы вызвать деформацию жидкости, т.е. сместить одни ее молекулы относительно других, необходимо преодолеть упругие силы, действующие между ними. Чем больше время пребывания молекулы в "одном месте", время "оседлости", тем больше вязкость и меньше текучесть жидкости.
Сжимаемость.
Так как молекулы в жидкостях находятся
значительно ближе друг другу, чем в
газах, то силы их межмолекулярного
взаимодействия, вандерваальсовы силы,
играют значительную роль, а, следовательно,
внутреннее давление
![]() в жидкостях очень велико.
в жидкостях очень велико.
На величину внутреннего давления в жидкостях, кроме того, влияет удельный объем, который в тысячи раз меньше, чем в газах.
Значительной величиной молекулярного (внутреннего) давления объясняется малая сжимаемость жидкостей. Коэффициент сжимаемости жидкостей K определяется соотношением
![]() (4)
(4)
где dV - уменьшение первоначального объема жидкости V при увеличении давления на dp.
Коэффициент сжимаемости жидкостей зависит от давления и температуры: с увеличением давления он уменьшается, а с повышением температуры - увеличивается. Уменьшение коэффициента сжимаемости с ростом давления обусловлено тем, что по мере сближения молекул возрастают силы отталкивания между ними. Его увеличение с ростом температуры связано с увеличением расстояния между молекулами, вследствие увеличения объема жидкости.
