
- •8. Молекулярно – кинетическая теория строения вещества
- •8.1. Молекулярно-кинетическая теория
- •8.2. Модель идеального газа. Основное уравнение состояния идеального газа
- •8.3. Основное уравнение кинетической теории газов
- •8.4. Молекулярно-кинетическая трактовка абсолютной температуры
- •8.5.Основные газовые законы молекулярно кинетической теории
- •8.5.1. Закон Бойля-Мариотта
- •8.5.2. Закон Гей-Люссака
- •8.5.3. Закон Шарля
- •8.5.4. Объединенный газовый закон Мариотта-Гей-Люссака
- •8.5.4. Закон Дальтона
- •9. Некоторые вопросы статистической физики
- •9.1. Распределение энергии по степеням свободы Число степеней свободы молекулы. Теорема Больцмана
- •9.2. Вероятность и флюктуации. Скорости теплового движения частиц
- •9.3. Распределение молекул (частиц) по скоростям.
- •Средняя длина свободного пробега молекул
- •9.4. Экспериментальное подтверждение молекулярно-кинетической теории газов (опыт Штерна)
- •9.5.Средняя длина свободного пробега молекул
- •9.6. Распределение Больцмана. Барометрическая формула
- •Внутренняя энергия. Первое начало термодинамики
- •9.8. Теплоёмкость газа. Уравнение Роберта Майера. Классическая теория теплоёмкостей
- •10. Элементы термодинамики
- •10.1. Первое начало термодинамики и его применение к изопроцессам в идеальных газах
- •10.1.1. Изохорный процесс
- •10.1.2. Изобарный процесс
- •10.1.3. Изотермический процесс
- •10.1.4. Адиабатический процесс
- •1 0.1.5. Работа и теплоёмкость при адиабатном процессе.
- •10.2. Основное уравнение термодинамики идеального газа. Энтропия.
- •10.3. Обратимые, необратимые и круговые процессы (циклы)
- •10.4. Цикл Карно. Максимальный кпд тепловой машины
- •10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
- •10.6. Второе начало термодинамики
- •10.7. Третье начало термодинамики (теорема Нернста)
- •11. Реальные газы
- •11.1. Реальные газы. Молекулярные силы
- •11.2.Уравнение Ван-дер-Ваальса
- •11.3. Изотермы Ван-дер-Ваальса
- •12.2. Диффузия и теплопроводность. Коэффициенты диффузии и теплопроводности
- •13. Элементы механики сплошных сред
- •13.1. Строение жидкостей
- •13.2. Свойства жидкостей (вязкость, текучесть, сжимаемость и тепловое расширение)
- •13.3. Поверхностное натяжение. Энергия поверхностного слоя жидкости
- •13.4. Давление под искривлённой поверхностью жидкости. Формула Лапласа
- •13.5. Поверхностные явления на границе раздела двух жидкостей или жидкости и твердого тела
- •13.6. Капиллярные явления. Закон Жюрена
- •13.7. Жидкие кристаллы, их строение и свойства
- •13.8. Магнитные жидкости
- •1 3.8.1. Структура магнитных жидкостей
- •13.8.2. Получение магнитных жидкостей
- •13.8.3. Свойства магнитных жидкостей
- •13.8.4. Применение магнитных жидкостей
- •13.9. Кристаллическое состояние
- •13.9.1. Отличительные черты кристаллического состояния
- •13.9.2 Физические типы кристаллических решеток
10.5. Тепловая машина, работающая по циклическому принципу. Перпетум мобиле второго рода
2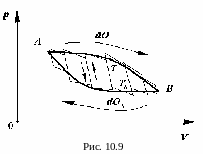 закон термодинамики:
«Невозможно
полностью превратить все тепло, полученное
от нагревателя, в работу».
Этот вывод справедлив не только для
тепловой машины, работающей по циклу
Карно, но и для тепловой машины, работающей
по любому циклическому принципу.
закон термодинамики:
«Невозможно
полностью превратить все тепло, полученное
от нагревателя, в работу».
Этот вывод справедлив не только для
тепловой машины, работающей по циклу
Карно, но и для тепловой машины, работающей
по любому циклическому принципу.
Рассмотрим произвольный замкнутый процесс (цикл), см. рис.10.9.
Мысленно мы можем разбить такой процесс на большое число элементарных циклов Карно. Полезная работа будет равна площади контура, которая в свою очередь равна сумме площадей примыкающих друг к другу элементарных циклов. Если элементарных циклов много, то элементарные изотермы практически сливаются с действительным процессом. Для каждого элементарного цикла
![]() =
=![]() .
.
Откуда
![]() ,
или
,
или
![]() т.е. dS
= dS0,
т.е. dS
= dS0,
Следовательно, dS
- dS0
= 0 и
![]()
- т.е при любом круговом (обратимом) процессе изменение энтропии = 0.
Таким образом, S - однозначная функция состояния, ее приращение не зависит от характера и последовательности процессов при переходе из одного состояния в другое, а определяется лишь исходным и конечным состояниями. С другой стороны в каждом элементарном цикле Карно существует Q0, передаваемая холодильнику.
Таким образом, тепловая машина, работающая по любому циклическому принципу, не может полностью превратить получаемое от нагревателя тепло в работу.
Принято называть тепловую машину, которая была бы в состоянии полностью превратить получаемое от нагревателя тепло в полезную работу, перпетуум мобиле 2го рода.
На основании вышеизложенного мощно заключить, что любая конструкция, реализующая перпетуум мобиле 2го рода (вечным двигателем второго рода), нереалистична и не следует тратить время на ее детальное изучение.
10.6. Второе начало термодинамики
На основании первого начала термодинамики, внутренняя энергия системы может изменяться только в результате совершения работы или передачи некоторого количества теплоты. Работа может совершаться или внешними силами, действующими на систему, или системой над внешними силами. Количество теплоты либо передается от каких-либо тел, не входящих в систему, либо отбираться от самой системы внешними телами. Следовательно, в изолированной системе внутренняя энергия не изменяется.
Возможные с точки зрения первого начала термодинамики процессы оказываются неравноценными в отношении их протекания: одни из них возможны, а другие нет. Например, при смешении двух порций жидкости с разной температурой с точки зрения первого начала термодинамики возможен любой процесс, в результате которого температура смеси установится и будет равна t, при этом должно выполняться соотношение
![]()
В то же самое время, возможен и такой процесс, при котором жидкость массой (m1 + m2), имеющая температуру t, самопроизвольно разделится на две порции массами m1 и m2 с различными температурами t1 и t2, при этом будет выполняться соотношение:
![]()
Однако в действительности последний процесс невозможен
Точно также при смешении водного раствора какой-либо соли с чистой водой всегда наблюдается диффузия, которая приводит к выравниванию концентрации раствора во всей жидкости. Однако никогда не наблюдается, чтобы растворенное в какой-либо жидкости вещество (соль) самопроизвольно собралось бы в одной ее части, в то время как во второй части оказался бы чистый растворитель.
На различие таких процессов и указывает второе начало термодинамики, которое можно сформулировать так: "В изолированной системе возможны только такие процессы, при которых энтропия системы возрастает". Т.е.
![]() или
или
![]() .
(1)
.
(1)
Следовательно, чтобы ответить на вопрос, возможен ли в изолированной системе тот или иной процесс, необходимо рассчитать изменение энтропии системы, которым сопровождается этот процесс и если оно положительно, то данный процесс возможен, если отрицательно - нет.
Формулировок второго начала термодинамики несколько, но все они приводят к одним и тем же выводам: "В изолированной системе при всех реальных процессах энтропия возрастает. Или невозможен процесс, единственным результатом которого является превращение в работу теплоты, полученной от нагревателя".
Таким образом, второе начало термодинамики определяет направление термодинамических процессов и указывает на физический смысл энтропии: энтропия - мера рассеяния энергии, т.е. характеризует ту часть энергии, которую нельзя превратить в работу.
