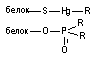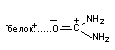2.1. Типи хімічних зв'язків, що утворюються між токсикантом і структурою-мішенню
При взаємодії токсиканту з біологічними структурами-мішенями можуть утворюватися різні типи хімічних зв'язків (таблиця 3).
Таблиця 3. Різні типи зв'язків, що формуються між токсикантами і молекулами-мішенями організму
Вид зв’зку |
Приклад |
Енергія зв’зку (кдж/мол) |
Іонний |
|
20 |
Ковалентний |
|
40 - 600 |
Донорно-акцепторний |
|
4 - 20 |
Іон-дипольний |
|
8 - 20 |
Диполь-дипольний |
|
4 - 12 |
Водневий |
|
4 - 28 |
Ван-дер-Ваальса |
|
1 - 4 |
Гідрофобний |
|
1 - 6 |
Іонний зв'язок. У водних розчинах багато речовини дисоціюють з утворенням іонів. Між позитивно і негативно зарядженими іонами токсиканту і ендогенними іонами-мішенями починають діяти сили електростатичного притягання. Внаслідок притягання виникає хімічний зв'язок. Зв'язок такого типу називається електровалентний або іонний. Утворені катіонами і аніонами речовини не несуть електричного заряду.
А-
+
В+ АВ
АВ
Токсичні наслідки подібної взаємодії в організмі розвиваються в разі утворення не розчинного у воді комплексу іона-токсиканту з біологічно значимим іоном-мішенню. Наприклад, при інтоксикації фторидами, іон фтору може вступати у взаємодію з іоном кальцію. В результаті утворюється нерозчинний фторид кальцію. Утворювана гіпокальціємія має певне значення для розвитку і прояви інтоксикації. Аналогічним чином діє щавлева кислота, яка утворюється в організмі в процесі метаболізму етиленгліколю при інтоксикації останнім:

Оскільки ступінь дисоціації багатьох речовин у водному розчині істотно залежить від рН середовища, кількість утворених за рахунок іонної зв'язку комплексів токсикант-мішень також залежить від цього показника.[2]
Ковалентний зв'язок. Для утворення ковалентного зв'язку, взаємодіючі атоми повинні мати на зовнішній електронній орбіті неспарені електрони. Ці електрони займають одну і ту ж орбіталь, а що утворилася загальна пара формує силу тяжіння між атомами. У результаті утворення такої загальної пари електронів кожен з взаємодіючих атомів набуває "завершений набір" електронів і утворене з'єднання стає стабільним. Енергія ковалентного зв'язку велика і складає 200 - 400 кдж / моль.
Висока стабільність зв'язку цього типу означає практично незворотній характер приєднання токсиканту до структури-мішені. Прикладами речовин, що утворюють з біомолекулами подібний зв'язок, є ФОС (взаємодіють із серином, що входить в структуру активного центра ацетилхолінестерази), іприти (взаємодіють з пуриновими основами нуклеїнових кислот), а також цілий ряд інших поширених токсикантів (метилбромід, метилхлорид, етиленоксидом та ін). Внаслідок міцності утвореного зв'язку, руйнування комплексу токсикант-біомішень можливо тільки за допомогою спеціальних засобів (наприклад, реактиваторів ХЕ при інтоксикації ФОС). Заповнення змісту пошкодженої токсикантом біологічної структури можливо також за рахунок її синтезу. Так, відновлення активності АХЕ у тканинах лабораторних тварин отруєних зоманом проходить зі швидкістю синтезу ензиму нервовими клітинами.
Координаційний зв'язок - це ковалентний зв'язок, у якому узагальнену пару електронів представляє лише один з атомів у зв'язку, що утворений. Один з атомів є донором, а інший акцептором електронної пари, тому цей зв'язок називають також донорно-акцепторним. Акцепторами часто є катіони металів, або атоми перехідних металів (Zn, Cu, Fe), що входять до складу молекули. Таким чином, зокрема, оксид вуглецю взаємодіє з залізом гемоглобіну, з утворенням карбоксигемоглобіну.
Водневий зв'язок. Ковалентний зв'язок між атомом водню і електронегативним атомом (кисень, азот, сірка і т.д.) більш-менш поляризований
![]()
Внаслідок цього атом водню набуває незначний позитивний заряд. Якщо поблизу такого атома знаходиться молекула або група, що містить аніон або електронегативний атом, між ними утворюється слабкий зв'язок, названий водневим.
Водневий зв'язок може утворюватися як між молекулами, так і між атомами всередині молекул. Енергія зв'язку не велика і у водному розчині становить близько 20 кдж / моль. Її міцність багато в чому залежить від будови взаємодіючих речовин, зокрема, від ступеня електронегативності атомів, пов'язаних з воднем. Електронегативність атомів зростає в ряді:
Н = P < C = S = I < Br < Cl = N < O < F
2,1 2,1 2,5 2,5 2,5 2,8 3,0 3,0 3,4 4,0
Водневі зв'язки мають дуже велике значення для підтримки просторової структури білків, нуклеїнових кислот та інших високомолекулярних сполук. Речовини, здатні руйнувати водневий зв'язок, можуть порушувати просторову структуру макромолекул (явище інтерколаціі: вбудовування молекул акридину, етідіумброміду між площинами, утвореними витками спіралі молекули ДНК).
До складу молекул токсикантів також входять групи, здатні брати участь в утворенні водневих зв'язків. Якщо ці групи (Х-Н) є структурними елементами "активного" радикала токсиканту, то вони беруть участь в утворенні складного зв'язку речовини з молекулою-мішенню. Оскільки водневі зв'язки є по суті електростатичними, їх сила слабшає в присутності речовин, що володіють властивостями діелектриків.
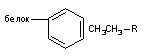
Зв'язки Ван-дер-Ваальса. Форма електронної хмари молекул квазістабільності, тобто не змінюється до тих пір, поки на неї не діють зовнішні сили. Під впливом електромагнітних полів електронні хмари молекул деформуються. При цьому байдуже чи викликано появу деформованих сил впливом зовнішніх полів або поле сформоване довколишніми іонами, диполями, аполярними молекулами. Ступінь деформації електронної хмари залежить від енергетичних характеристик впливу полів і поляризації самої молекули. Здатність електронної хмари до деформації (поляризованість) залежить від розмірів молекули. У великих молекул вона більша, ніж у малих, оскільки змістити електрони, що знаходяться на значній відстані від ядра атома, легше.
Деформуюча дія полів перетворює неполярні молекули в диполі, так як центри максимальної щільності позитивного і негативного заряджених молекул роз'єднуються в просторі. Сформуваний диполь називають індукованим чи тимчасовим, оскільки він перестає існувати відразу після припинення дії деформуючих сил. Дві прилеглі неполярні молекули можуть взаємно індукувати утворення тимчасових диполів і, таким чином взаємодіяти один з одним. Сили взаємодії, що формуються між тимчасовими диполями, називаються силами Лондона - Ван-дер-Ваальса. Енергія утвореного зв'язку мала, однак вона істотно зростає при збільшенні числа ділянок контакту між взаємодіючими молекулами. З боку токсиканту це можуть бути ароматичні, гетероциклічні, алкільні радикали; зі сторони рецептора - неполярні ділянки молекул амінокислот (лейцин, валін, аланін, пролін та ін.) Внесок кожної-СН2-групи алкільного ланцюга у взаємодію оцінюється в 2 - 4 кдж / моль. При тісному контакті великих неполярних молекул енергія зв'язку може досягти дуже великих величин. Тому при утворенні комплексу токсикант-біомішень сили Ван-дер-Ваальса можуть забезпечувати дуже міцну фіксацію ксенобіотика. Діюча сила, відповідає за формування зв'язку, обернено пропорційна сьомій степені відстані між взаємодіючими молекулами. Тому вона не може забезпечити притягання молекул токсиканти, вільно циркулюючих в біосередовищах, до рецептора. У цьому процесі першорядну роль грають сили електростатичної взаємодії. Однак після того як контакт між токсикантом і рецептором здійснився сили Ван-дер-Ваальса забезпечують його орієнтацію і щільну фіксацію.[5]
Гідрофобна взаємодія. Гідрофобні зв'язки формуються у водному середовищі, коли молекули взаємодіючих речовин контактують один з одним неполярними (гідрофобними) ділянками. На відміну від взаємодії Ван-дер-Ваальса і донорно-акцепторної взаємодії, які також формуються при взаємодії неполярних груп, утворення гідрофобних зв'язків зумовлене властивостями води, без участі якої взаємодія відбуватися не може. У відповідності з теорією, молекули води пов'язані один з одним водневими зв'язками, утворюючи тривимірну структуру (кластер), що нагадує структуру льоду. На кордоні поверхні, що розділяє неполярну молекулу і молекули води, утворення такої структури утруднюється. При контакті двох неполярних молекул, розчинених у воді, загальна площа поверхні, що розділяє воду і ці молекули зменшується. Внаслідок цього, мобілізується частина молекул води, організованих у кластер. На противагу всім іншим хімічним зв'язкам і взаємодіям гідрофобний зв'язок, таким чином, обумовлений перетворенням розчинника (води), а не розчинених взаємодіючих речовин. Рушійною силою утворення зв'язку є зростання ентропії цілісної системи розчинник - розчинені молекули. Структурна організація гідрофобних, взаємодіючих молекул зростає (зменшення ентропії), але при цьому істотно дезорганізується (ентропія зростає) структура розчинника (води).
Гідрофобні зв'язки мають велике значення при взаємодії неполярних молекул ксенобіотиків з клітинними і внутрішньоклітинними мембранами, для утворення їх комплексів з білками, при цьому можливе порушення конформації макромолекул.
У процесі взаємодії низькомолекулярної речовини з біомішенню практично завжди формується кілька типів зв'язків (малюнок 3), оскільки молекула токсиканту, як правило, включає полярний (іноді навіть іонізований), і неполярний фрагменти.

Малюнок 3. Етапи взаємодії молекули токсиканту з біомішенню
Іонні зв'язки, за рахунок яких здійснюється тяжіння молекули до біомішені, мало специфічні (аналогічно іон-дипольному і диполь-дипольній взаємодії). Взаємодія між неполярними групами також неспецифічна. Однак, якщо в структурі мішені (наприклад, рецепторі для ендогенних біорегуляторів) полярні і неполярні групи просторово організовані, між цими ділянками і особливими ділянками молекули токсиканту утворюються специфічні зв'язки, обумовлені просторовою організацією молекули токсиканту. Таку взаємодію можна порівняти з орієнтацією намагніченості стрілок в магнітному полі. Після орієнтації молекули за допомогою іонної (диполь-дипольної) взаємодії між нею і рецептором формується тісний контакт, і утворюються зв'язки за рахунок водневих сил і сил Ван-дер-Ваальса. Утворений комплекс тим більш міцний, ніж більш комплементарна молекула токсиканта рецептору.[7]
Розділ 3. Фізико-хімічні властивості речовини
Фізико-хімічні властивості речовин істотним чином позначаються на їх токсичності. Визначальними є: розчинність у воді, розчинність в ліпідах, кислотно-основна природа токсиканту.
а) розчинність у воді.
Розчинність токсиканта у воді - необхідна умова його резорбції у внутрішньому середовищі організму: corpora non agunt nisi soluta (що не розчиняється, то не діє). Для того, щоб досягти структури-мішені токсикант також повинен потрапити у водну фазу, так як вода - основа міжклітинної рідини організму. Полярність молекули води вимагає і від токсиканту відомої полярності. Тому розчинність речовини у воді залежить від наявності та кількості в його молекулі полярних груп і їх будови (таблиця 1).
Таблиця 1. Розчинність деяких похідних бензолу у воді (г/100г; С300)
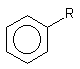
R |
-C2H5 |
-J |
-Br |
-Cl |
-CH3 |
-F |
-NO2 |
-SO3H |
г/100г води |
не розтв. |
0,034 |
0,045 |
0,049 |
0,057 |
0,15 |
0,19 |
розтв. |
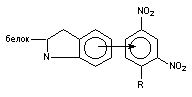
Деякі речовини виявляють властивості кислот або основ і, отже, можуть знаходитися в розчині в протонованій або депротонованій формі. Це також позначається на їх розчинності (малюнок 2).
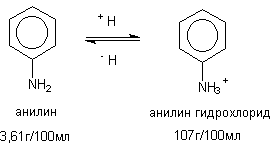
Малюнок 2. Розчинність аніліну та його протонованого похідного
Як видно з наведеного рисунка, наявність заряду в молекулі токсиканту істотно позначається на його здатності розчинятися у воді, підсилюючи диполь-диполь взаємодію розчинника і розчиненої сполуки.
б) розчинність у ліпідах.
Розчинність у ліпідах має основне значення для процесів проникнення і розподілу великих молекул токсикантів в організмі. Крім того, чим вище розчинність речовини в ліпідах, тим гірше воно виводиться з організму. Мірою жиророзчинності токсикантів є кількість речовини, що здатна до розчинення в одиниці об'єму рідких масел або органічних розчинників. При аналізі отриманих результатів слід мати на увазі, що в різних розчинниках речовина розчиняється по-різному. Так, розчинність амідопірину (г/100г; 370С) в бензолі становить 0,81; в топленому салі - 1,7; рослинній олії - 2,0; суміші бензолу і лецитину (1:1) - 12,6; хлороформі - 120, 6.
Нерозчинні в жирах молекули можуть потрапити в організм з навколишнього середовища лише в тому випадку, якщо вони проходять через пори біологічних мембран, або переносяться через бар'єри за допомогою спеціальних механізмів, наприклад, піноцитозу і т.д.
Великі, нерозчинні у ліпідах речовини, як правило, відносяться до числа малотоксичних.
Жиророзчинні і водорозчинні - пов'язані між собою властивості. Чим полярніша молекула речовини, тим краще вона розчиняється у воді і гірше - в ліпідах. Найбільшою біологічною активністю, як правило, володіють токсиканти з проміжною розчинністю. У цьому зв'язку важливою токсикологічною характеристикою є коефіцієнт розподілу речовини в середовищах: масло - вода або гептан - вода. Для деяких речовин їх біологічна активність пропорційна величині цього коефіцієнта (таблиця 2)
Таблиця 2. Залежність токсичності аліфатичних спиртів від їх жиро- і водо розчинності.
Параметри |
СН3ОН |
С2Н5ОН |
С3Н7ОН |
С4Н9ОН |
С5Н11ОН |
С6Н13ОН |
С8Н17ОН |
ЛД50 в/в (мМ/кг) Миші |
177 |
53,7 |
18,2 |
5,09 |
2,09 |
1,01 |
0,53 |
Гемоліз еритроцитів кроля (М) |
7,43 |
4,11 |
0,80 |
0,44 |
0,18 |
0,06 |
0,02 |
Пригнічення активності каталазу на 50% (М) |
3,6 |
3,47 |
2,36 |
1,95 |
1,33 |
- |
- |
|
|
|
|
|
|
|
|
Чітку кореляцію можна простежити лише в гомологічних рядах токсикантів, при цьому оцінювані ефекти, як правило, неспецифічні (денатурація ензиму, порушення властивостей біологічних мембран, наркоз, пошкодження клітини, смерть).
Для специфічної взаємодії токсиканту зі структурою-мішенню розчинність у воді або ліпідах має невпорядковане значення.
в) кислотно-основна природа токсиканту.
Численні токсиканти є слабкими кислотами або основами, тобто можуть, в залежності від рН середовища, знаходитися в протонованій або депротонованій формі. Кислоти, перебуваючи в протонованій формі - незаряджені молекули, азотисті основи, навпаки, являють собою катіони. У депротонірованій формі кислоти являють собою аніони, а основи - не заряджені. Сила кислоти або основи визначається здатністю до дисоціації, яка характеризується величиною константи дисоціації (Ка або рКа-негативний десятковий логарифм значення Ка). Чим вище значення рКа, тим легше здійснюється процес протонування речовини. Основи з високим значенням рКа - більш сильна основа; кислота з високим рКа - слабка кислота. Так, диметиламін (рКа 10,7) - більш серйозна основа, ніж N-метиланілін (рКа 4,7); фенол (карболова кислота рКа 9,9) - більш слабка кислота, ніж бензойна кислота (рКа 4,2). Співвідношення іонізованої і неіонізованої форм токсиканту в середовищі крім величини рКа, визначається рН середовища. Зі збільшенням рН збільшується число незаряджених молекул основ і заряджених аніонів кислот.
Часто іонізація токсиканту супроводжується посиленням його спорідненості до рецептору, проте одночасно утруднюється проходження молекули через біологічні бар'єри.
Сильні кислоти і луги (повністю дисоціюють у водних розчинах), при дії на тканини організму, різко змінюючи рН, викликають денатурацію макромолекул клітин. Цей процес лежить в основі хімічного опіку покривних тканин.[1]
Розділ 4. Стабільність в середовищі
Біологічну дію токсикант може надавати лише за умови його достатньої стабільності в навколишньому середовищі і середовищі організму. Якщо речовина нестабільна, то розвивається ефект пов'язаний з впливом продуктів його перетворення. Активні в хімічному відношенні речовини рідко стають безпосередніми причинами загальнотоксичної дії. Ці речовини, або вже в навколишньому середовищі вступають в хімічні реакції, перетворюючись на більш інертні, але відносно стабільні з'єднання, або реагують з покривними тканинами організму (шкірою, слизовими), розтрачуючи свій хімічний потенціал на їх альтерацію (місцеву дію).
Після потрапляння в організм більша частина ксенобіотиків з різною швидкістю піддається біотрансформації. Так, при надходженні в шлунково-кишковий тракт пептиди і білкові молекули (наприклад, тетанотоксин) швидко інактивуються пептидазами і протеїназми. У процесі руйнування токсикантів різної будови бере участь і кишкова флора. Метаболізм ксенобіотиків завершується в крові і тканинах після їх розробки. Тому, часом, дуже важко вирішити, яка саме речовина є безпосередньо діючим початком розвитку токсичного процесу.[6]
Висновки
Теоретично люба молекула організму може стати мішенью для дії тих чи інших токсикантів. Однак значення різних класів і видів молекул для підтримки гомеостаза організма не однакові, наслідки цієї дії різні. При токсичному порушені елемента страждає функція молекулярної системи в цілому.
Більшість токсикантів – слабкі кислоти або основи. Зі збільшенням рН збільшується кількість незаряджених молекул основ і заряджених аніонів к-т. при різкій зміні рН визивається денатурація макромолекул.
Біологічна дія достаточна при стабільності в оточуючому середовищі. Якщо речовина нестабільна, тоді ефект пов'язаний з дією продуктів його біотрансформації.
Дія токсикантів на структурні елементи клітин: білки, нуклеїнові кислоти, ліпідні елементи мембран, селективні рецептори ендогенних біорегуляторів. Особливе значення – дія ксенобіотиків на ферменти: усилення каталітичної активності, пригнічення каталітичної активності, зміни конформації ферментів.
Список використаних джерел
Актуальные вопросы экологической токсикологии. Сборник научных трудов. - Иваново. - 1978 -117 с.
Губский Ю.И., Долго-Сабуров В.Б., Храпак В.В. Химические катастрофы и экология. - К.: Здоровье. —1993. —224 с.
Головко А.І. і співавт. Токсикологія ГАМК-літики. - СПб.: НИВА, 1996. -141 с.
Головко А.І., Куценко С.А., Івницький Ю.Ю. та ін Екотоксикологія. - СПб.: НІІХВ СПбГУ, 1999.- 124 с.
Исидоров В.А. Введение в химическую экотоксикологию. Учебное пособие. - СПб.: Химиздат, 1999. - 142 с.
Куценко С. А."Основи токсикології» Санкт-Петербург, - 2002 р.- 396 с.
Экологические аспекты экспертизы изобретений. - М.: ВНИИПИ. —1991.-450 с.