
Технология синтеза мономеров / Основы химии и технологии мономеров Елигбаева
.pdf
|
O |
|
CH – C |
|
|
C4H10 + 3,5O2 → || |
O + 4H2O |
ΔH298 = -1240 кДж/моль |
CH – C |
|
|
|
O |
|
Лучшим катализатором в этих процессах является V2O5, промотированный фосфатами. Процесс ведут при 440-500ºС аналогично синтезу малеинового ангидрида из бензола. Селективность по целевому продукту в этих процессах несколько ниже и не превышает 50%.
Фталевый ангидрид – это исходный мономер для производства алкидных смол, образующихся в процессе его поликонденсации с глицерином,
пентаэритритом и другими многоатомными спиртами. Кроме того фталевый ангидрид – полупродукт для получения пластификаторов, репелентов
(препараты для отпугивания комаров и гнуса), красителей.
Сырьем для промышленного получения фталевого ангидрида служат нафталин или о-ксилол, которые подвергают гетерофазному окислению кислородом воздуха в присутствии стационарного или кипящего слоя катализатора. При этом окисление сырья протекает согласно уравнениям:
Окисление нафталина:
О
С |
|
+ 4,5О2 → |
О + 2СО2 + 2 Н2О |
С |
|
О |
Н298 = -1790 кДж/моль |
Побочные реакции:
С10Н8 + 12О2 → 10СО2 + 4Н2О
O
CH – C
С10Н8 + 12О2 → || 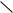 O + 6CO2 + 3H2O
O + 6CO2 + 3H2O
CH – C 
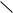 O
O
111

Окисление о-ксилола:
СН3 |
О |
|
|
С |
|
+ 3О2 → |
О + 3Н2О |
|
СН3 |
С |
|
|
О |
Н298 = -1780 кДж/моль |
Окисление о-ксилола также сопровождается реакциями образования малеинового ангидрида и полного сгорания сырья. Условия окисления нафталина и о-ксилола аналогичны. Парофазное окисление сырья проводится в трубчатых реакторах, имеющих несколько тысяч трубок, заполненных катализатором. Отвод тепла осуществляется жидким теплоносителем
(расплавом солей нитрит-нитрат или эвтектической смесью натрия и калия),
находящимся в межтрубном пространстве. В качестве катализаторов окисления используют пентаоксид ванадия и диоксид титана. Окисление проводят при
350-400 ºС избытком воздуха при мольном отношении воздух: углеводород между 60 и 120, т.е. ниже нижнего предела области воспламенения.
При производстве фталевого ангидрида образуется большое количество газов. Основным методом выделения фталевого ангидрида является десублимация, осуществляемая в теплообменниках с ребристыми трубами,
обтекаемыми в поперечном направлении газовой смесью. Таким образом удается осадить на трубах до 99,5% твердого фталевого ангидрида,
находящегося в реакционном потоке. Выход фталевого ангидрида при окислении о-ксилола составляет 75-80%, а при окислении нафталина – 85-88%.
Одна из схем производства фталевого ангидрида из нафталина изображена на рисунке 63.
Расплавленный нафталин при ≈ 100ºС подают в испаритель 2, имеющий несколько колпачковых тарелок. Туда же вводят часть воздуха (предварительно подогретого в аппарате 1), который насыщается парами нафталина до
112
концентрации 8-10%, что превышает верхний предел взрываемости. Остальной воздух нагревают в теплообменнике 3 горячим реакционным газом, смешивают с воздухом, насыщенным парами нафталина, и подают смесь в трубчатый реактор 4. Реактор охлаждается теплоносителем (расплавом солей). При этом аккумулированное теплоносителем реакционное тепло используется для выработки пара в котле-утилизаторе 5. Горячие реакционные газы, выходящие из реактора, охлаждают затем в теплообменниках 3 или 6 (в разных схемах) и
далее поступают в один из двух сменных конденсаторов 7 с ребристыми трубами, охлаждаемыми маслом; фталевый ангидрид отлагается на трубах в твердом виде.
Рисунок 63. Технологическая схема получения фталевого ангидрида из нафталина:
1 – подогреватель; 2 – испаритель; 3, 6 – теплообменники; 4 – реактор; 5 – котел-утилизатор; 7 – конденсаторы; 8 – емкость; 9, 10 – ректификационные колонны; 11 – паросборники; 12 – дефлегматоры-конденсаторы; 13 – кипятильники
По мере накопления его расплавляют (предварительно переключив
реакционный поток на второй конденсатор 7) и собирают в промежуточную
емкость 8, а затем отправляют на очистку в систему двух ректификационных
колонн 9 и 10. Легкий погон колонны 9 и тяжелый кубовый остаток колонны 10
113

сжигают. Целевой очищенный фталевый ангидрид отводят через конденсатор
12.
В настоящее время существуют также технологические схемы для жидкофазного окисления о-ксилола, где удается повысить выход фталевого ангидрида до 90%.
Пиромеллитовый ангидрид относится к группе диангидридов тетракарбоновых кислот, которые при двухстадийной поликонденсации с ароматическими диаминами образуют ряд так называемых гетероциклических полимеров, цепи которых содержат гетероциклы, конденсированные с ароматическими ядрами. Эти полимеры отличаются исключительно высокой термостойкостью; полимерные материалы на их основе (пленки, покрытия,
стекло- и углепластики) могут эксплуатироваться без потери прочности при температуре около 500 ºС. Кроме того они огнестойки, т.е. применимы в пожароопасных условиях.
Пиромеллитовый ангидрид служит мономером для синтеза термостойких полиимидов, применяемых для производства термостойких пленок и волокон,
востребованных в высокотехнологичных отраслях: авиа- и машиностроении,
ракетной и военной технике.
В промышленности пиромеллитовый ангидрид производят методом пароили жидкофазного каталитического окисления дурола (1,2,4,5-
тетраметилбензола). Сырьем для самого дурола служат фракции С9-С10
каталитического риформинга и фракции разгонки каменно-угольной смолы.
Процесс окисления описывается следующим уравнением:
H3C |
CH3 |
OC |
CO |
|
+ 6O2 → O |
|
O + 6H2O |
H3C |
CH3 |
OC |
CO |
114
При жидкофазном окислении дурола в качестве окислителей применяют азотную и хромовую кислоты, перманганат калия, хлор, сернистый ангидрид.
Поскольку жидкофазное окисление проводят в водных растворах, первичными продуктами превращения является пиромеллитовая кислота, которая далее подвергается очистке и последующей дегидратации для перевода ее в диангидрид.
Имеется промышленный вариант жидкофазного производства пиромеллитового диангидрида окислением дурола кислородом воздуха в присутствии катализаторов: ацетатов кобальта, солей церия. В качестве инициаторов окисления используют бромид натрия и тетрабромэтан.
Окисление протекает в среде уксусной кислоты при температурах 140-230ºС.
Недостатком описанного метода является высокотемпературная коррозия реактора агрессивной реакционной системой.
Разработан также двухстадийный способ получения пиромеллитовой кислоты. На первой стадии дурол окисляют воздухом под давлением 1,5 МПа при 165-170ºС в присутствии стеарата кобальта до получения оксидата с кислотным числом 250-300. На второй стадии оксидат дурола доокисляют 17- 20%-ной азотной кислотой в титановом автоклаве. Выход пиромеллитовой кислоты составляет 80-85%, далее ее дегидратируют до ангидрида.
Более распространенным промышленным способом получения непосредственно пиромеллитового ангидрида является газофазный процесс каталитического окисления дурола воздухом при температуре 410-450ºС в присутствии различных катализаторов, основой которых служит пентоксид ванадия V2O5. В продуктах реакции парофазного окисления дурола кроме пиромеллитового диангидрида содержится ряд соединений как неполного окисления дурола, так и его более глубокого окисления. Выход целевого продукта – пиромеллитового ангидрида составляет 65-75%.
115
В связи с дефицитом дурола разработаны другие методы получения пиромеллитового диангидрида на основе ксилолов, псевдокумола (1, 2, 5 -
триметилбензола) и антрацена.
4.1.4 Дихлорангидриды кислот
Дихлорангидриды кислот используют в реакции поликонденсации взамен свободных кислот в тех случаях, когда активность последних недостаточна для эффективной реакции полимерообразования. Поскольку дихлорангидриды значительно более активны, удается проводить поликонденсацию при более мягких условиях (при комнатной температуре), избежать протекания побочных реакций и получить полимеры с более высокой молекулярной массой.
К этой группе полимеров относятся дихлорангидриды ароматических дикарбоновых кислот и угольной кислоты.
Дихлорангидриды изо- и терефталевой кислот Cl(O)C–C6H4–C(O)Cl
применяются в реакции поликонденсации с ароматическими диаминами для получения полностью ароматических полиамидов, играющих важную роль в создании термостойких и высокопрочных волокон и пленок, теплостойкость которых составляет 350-400ºС. К ним относится, например, волокно «кевлар»,
на основе дихлорангидрида терефталевой кислоты и п-фенилендиамина,
выпускаемое в США и имеющее температуру плавления 390ºС. Кроме того оно обладает высокой прочностью, негорючестью и используется для изготовления пуленепробиваемых жилетов, касок, спортивного инвентаря. Его аналог м,м– строения, на основе изофталоилхлорида и м-фенилендиамина под названием
«номекс» (США) или «фенилон» (СССР, г.Кустанай) существенно превосходит
«найлон-6,6» по теплостойкости (его температура плавления 330ºС),
устойчивости к радиации и к термоокислительной деструкции. Высокая прочность и износостойкость позволяет применять это волокно в качестве корда при изготовлении шин самолетов и большегрузных машин.
116
Сами ароматические дикарбоновые кислоты недостаточно активны по отношению к диаминам ароматического строения. Именно поэтому их переводят в значительно более активную форму хлорангидридов.
В промышленности реализовано несколько методов получения хлорангидридов дикарбоновых кислот. Наиболее эффективны два процесса синтеза: на основе ксилолов или соответствующих дикарбоновых кислот. Если в качестве сырья используется ксилолы, то схема синтеза включает следующие реакции:
hν
CH3 – C6H4 – CH3 + Cl2 → CCl3 – C6H4 – CCl3 t
Cl3C–C6H4–CCl3 + RCOOH → ClOOC–C6H4–COOCl + RCOOCl + HCl
На первой стадии проводится исчерпывающие хлорирование ксилолов в боковые цепи в паровой фазе под действием УФ-облучения. Затем образовавшиеся трихлорметильные производные на второй стадии омыляют карбоновой кислотой, получая два хлорангидрида и HCl. Реакцию проводят в присутствии катализатора (хлориды железа или цинка) при 150ºС или в его отсутствие при более высокой температуре – 270-330ºС.
Другой метод синтеза дихлорангидридов предполагает прямое хлорирование соответствующих дикарбоновых кислот в избытке жидкого тионилхлорида (дихлорангидрида серной кислоты):
ArCOOH +SO2Cl2 → ArCOCl + SO3 + HCl
Достоинством этого процесса явялется то обстоятельство, что побочными продуктами являются газообразные вещества, легко удаляющиеся при перегонке хлорангидрида. Это облегчает выделение целевого продукта после реакции путем ректификации расплава дихлорангидрида.
117
Дихлорангидрид угольной кислоты Cl–C(O)–Cl (фосген) применялся в годы первой мировой войны в качестве боевого отравляющего вещества,
вызывающего удушье. Его смертельная концентрация составляет от 3,2 мг/л
при экспозиции 1 мин. Теперь он используется в качестве полупродукта при синтезе изоцианатов, а также как мономер в реакции поликонденсации с бисфенолами для получения поликарбонатов. В частности, на его основе при взаимодействии с n,n′-(дифенилол)-пропаном (бисфенолом–А) производят полиэфир под маркой «лексан» (США), «макролон» (Германия), являющийся на сегодняшний день наилучшим органическим стеклом – прочным,
погодоустойчивым, долговечным пригодным для любых видов механической обработки.
Фосген получают в промышленности прямым взаимодействием хлора и оксида углерода в присутствии активированного угля в качестве гетерогенного катализатора:
Cl2 + CO → COCl2 |
ΔH = 109,1 кДж/моль |
Реакция является экзотермической и вследствие этого равновесие при повышении температуры смещается влево. Равновесие практически полностью смещается вправо при температуре около 200-250ºС. Для отвода выделяющего тепла процесс проводят в трубчатом реакторе, в трубках которого на активированном угле происходит образование фосгена, а в межтрубном пространстве циркулирует вода, являющаяся хладоагентом. Образовавшийся фосген из катализата удаляется путем конденсации при охлаждении водой или рассолом. Остатки фосгена удаляются путем абсорбции.
4.2 Гидроксисодержащие мономеры
Наиболее важными мономерами с функциональными группами –ОН в молекуле являются ди- и полифункциональные гидроксипроизводные :
118
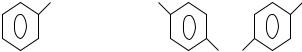
гликоли, глицерин, пентаэритрит, фенолы и бисфенолы. Они участвуют во многих реакциях поликонденсации: с дикарбоновыми кислотами (и их производными) они образуют большую группу полиэфиров; при их взаимодействии с диизоцианатами получают полиуретаны; поликонденсацией фенолов с формальдегидом синтезируют фенольно-формальдегидные смолы. К
этой же группе мономеров относятся используемые в синтезе полиуретанов ди-
и триэтилен- и пропилен гликоли, а также их низкомолекулярные (м.м. = 350-
500) олигомерные аналоги, которые получаются подобно этиленгликолю,
путем гидратации этиленили пропиленоксидов.
Химическая структура этих мономеров соответствует формулам:
HOCH2 – CH2OH; |
CH3 – CH(OH) – CH2OH; |
HO – (CH2)4 – OH; |
этиленгликоль |
пропиленгликоль |
бутиленгликоль |
HOCH2 – CH(OH) – CH2OH
глицерин
СН2ОН |
OH |
HO |
OH |
| |
|
|
|
НОН2С – С – СН2ОН |
|
|
A |
| |
фенол |
|
|
СН2ОН |
|
|
бисфенол |
пентаэритрит |
|
где А = СН2, О, SO2, C(CH3)2 |
|
НО – (СН2)2О(СН2)2 – ОН |
НОСН2 – (СН2ОСН2)2 – СН2ОН |
диэтиленгликоль |
триэтиленгликоль |
НОСН2 – (СН2ОСН2)n – СН2ОН поглигоэтиленгликоль
119

4.2.1. Гликоли
Этиленгликоль. Большая часть производимого в мире этиленгликоля используется для получения полиэтилентерефталата (ПЭТ-полимера), который идет на производство волокна «лавсан» («терилен»), прозрачный бутылочной тары и пленки. Его применяют также в производстве полиуретанов и алкидных смол. До 40% производимого этиленгликоля используют для производства антифризов («тосол» и другие).
Основным промышленным способом получения этиленгликоля является гидратация этиленоксида в присутствии кислотного катализатора (H2SO4 и др.):
СН2 – СН2 + Н2О → НОСН2СН2ОН |
Н238 = -75 кДж/моль |
О |
|
Процесс получения этиленоксида включает следующие стадии:
гидратацию этиленоксида; нейтрализацию кислого катализатора; перегонку и ректификацию гликоля.
Гидратацию этиленоксида водой проводят при 150-200ºС, 1,5-2,0 МПа и соотношении вода:этиленоксид, равном 20:1. Большой избыток воды необходим для того, чтобы снизить долю образования побочных продуктов – олигоэтиленгликолей.
После завершения реакции кислотный катализатор нейтрализуют содой или щелочью. При продолжительности реакции 1ч достигается селективность по этиленгликолю ~90%, выход диэтиленгликоля составляет ~10% и
триэтиленгликоля – 0,5%.
Водный раствор гликолей концентрируется в каскаде выпарных аппаратов, работающих при уменьшающемся давлении от первого к последнему аппарату от 0,6 до 0,1 МПа. Гликоли получают удалением воды в
120
