
- •Содержание
- •ВВедение
- •Техника безопасности
- •Работа 1 Техника лабораторных работ
- •Работа 2 методы очистки веществ
- •Перекристаллизация
- •Возгонка
- •Перегонка
- •Очистка газов
- •Экспериментальная часть
- •Вопросы к допуску
- •Работа 3 Определение эквивалента простых и сложных веществ
- •Вопросы к защите
- •Работа 4 определение атомных и молярных масс
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 5 классы неорганических соединений и периодическая система элементов. Типы химических реакций
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 6 Комплексные соединения
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 7
- •Теплоты химических процессов
- •Рассчитывают стандартную теплоту реакции на основе следствий из закона Гесса.
- •Опыт1. Определение теплоты гидратации карбоната натрия
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 8 скорость химических реакций. Химическое равновесие. Катализ
- •Опыт1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Зависимость скорости реакции от температуры
- •Опыт 3. Гомогенный катализ
- •Опыт 4. Скорость гетерогенных химических реакций
- •Опыт 5. Смещение химического равновесия при изменении концентрации реагирующих веществ
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 9 Приготовление растворов заданной концентрации
- •Способы выражения количественного состава растворов
- •Приготовление растворов с заданной массовой долей вещества а) из твердого вещества и воды
- •Б) из концентрированного раствора и воды
- •В) Смешивание двух растворов с различной массовой долей вещества
- •2. Приготовление растворов определенной молярной и молярной концентраций эквивалента. А) из твердого вещества и воды.
- •Б) из концентрированного раствора и воды
- •Вопросы к допуску
- •Вопросы к защите
- •Работа 10 Реакции в растворах электролитов
- •Вопросы допуска
- •Вопросы к защите
- •Вопросы допуска
- •Вопросы к защите
- •Вопросы допуска
- •Вопросы к защите
- •Литература
Вопросы к допуску
Почему зависимость растворимости твёрдых веществ в воде от температуры может иметь различный характер (рис. 2.1)? При ответе используйте принцип смещения равновесия Ле-Шателье.
Чтобы получить более чистые кристаллы, как нужно охлаждать раствор – быстро или медленно?
В каких случаях применяется фильтрование под вакуумом, без вакуума?
Сколько г CuSO4 5H2O и воды необходимо взять для приготовления 30 г раствора, содержащего 34,9% CuSO4 (опыт 2.1)?
Сколько г CuSO4 выпадает в осадок при охлаждении 30 г раствора, содержащего 34.9% CuSO4 , до 20С? При 20С насыщенный раствор сульфата меди содержит 17,2% CuSO4 (опыт 2.1).
В чём отличие ректификации от простой перегонки?
Как перегонять жидкости с высокой температурой кипения (способные к окислению, осмолению при высокой температуре)?
Можно ли очищать получающийся в аппарате Киппа углекислый газ от паров HCl с помощью растворов едкого натра, карбоната натрия? Напишите уравнения реакций.
Работа 3 Определение эквивалента простых и сложных веществ
Эквивалент - реальная или условная частица вещества, которая эквивалентна по химическому действию одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
Масса одного моль эквивалентов вещества называется молярной эквивалентной массой вещества.
Из существа понятий о химическом эквиваленте вытекает закон эквивалентов: вещества взаимодействуют в количествах, равных их эквивалентам или массы участвующих веществ пропорциональны молярным массам их эквивалентов
Математическое выражение закона имеет вид:
![]() . (1)
. (1)
Это же выражение можно записать в другом виде:
![]() (2)
(2)
где m1, m2 – массы веществ; Мэкв1, Мэкв2 – молярные массы эквивалентов веществ.
Эквивалент вещества может иметь разные значения, что зависит от реакции, в которой участвует вещество.
Для экспериментального определения молярной массы эквивалентов используют следующие методы:
1. Метод прямого определения. Молярная масса эквивалента определяется из данных прямого синтеза кислородного или водородного соединения данного элемента.
2. Аналитический метод. Производится точный анализ соединения данного элемента с любым другим, эквивалент которого известен.
3.Метод вытеснения водорода. Метод применяется для определения молярной массы эквивалентов металлов, способных вытеснять водород из разбавленных кислот и щелочей. Эквивалент определяется из отношения веса данного элемента к весу или объему вытесненного им водорода.
4. Электрохимический метод. Определяется весовое количество элемента, осаждающееся на электроде при электролизе соли данного элемента. (Эквивалент рассчитывается по закону Фарадея).
5. Теоретический
метод. Химический эквивалент можно
вычислить, зная атомный вес и валентность
элемента:
![]() , (3)
, (3)
где Ar – атомная масса, В – валентность.
Опыт 3.1. Определение эквивалента металла методом вытеснения водорода
Прибор для определения химического эквивалента металлов (рис. 3.1) состоит из бюретки (1) (ёмкостью 50 мл), соединённой посредством резиновых трубок с воронкой (2) и двухколенной пробиркой (3) (пробирка Оствальда). (можно использовать обычную пробирку.)
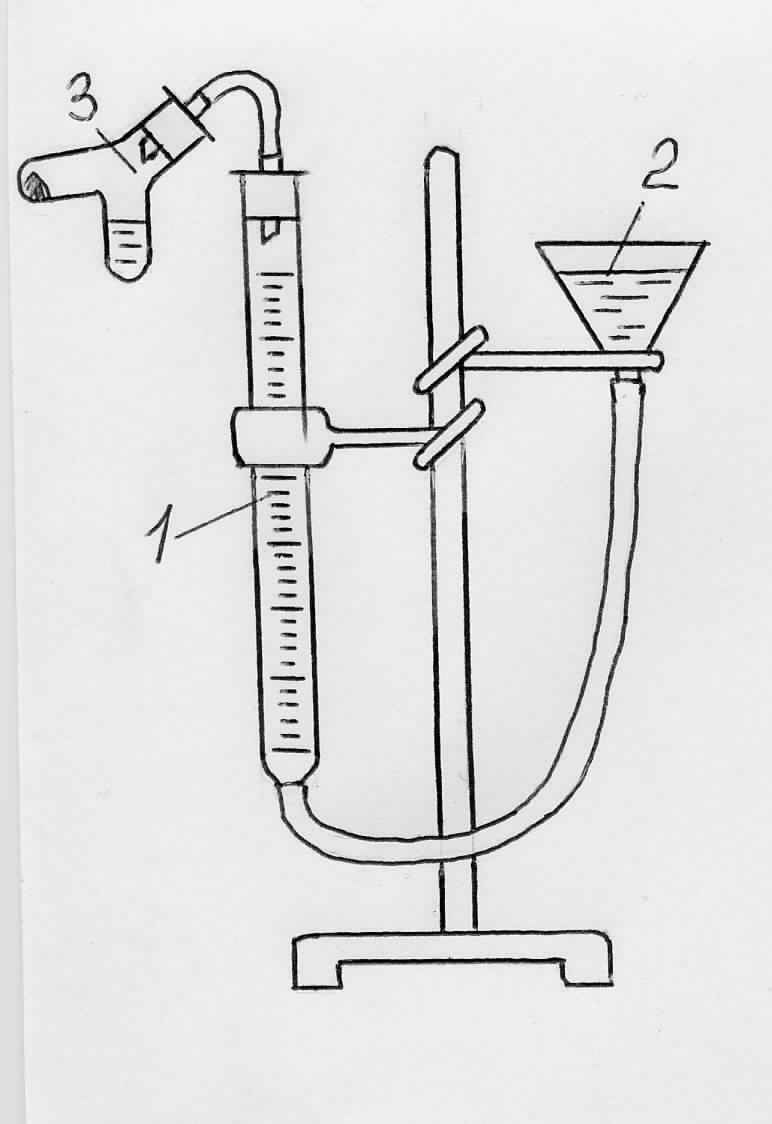
Рис. 3.1. Прибор для определения эквивалента простых веществ
Соберите прибор. Перед началом проведения опыта проверьте прибор на герметичность. Для этого в бюретку (1) налейте воду, которая заполняет также резиновую трубку, соединяющую бюретку с воронкой. Затем бюретку соедините с пробиркой и заметьте уровень воды в бюретке. Опусканием кольца штатива переместите воронку вниз. Если прибор герметичен, то в первый момент опускания воронки уровень воды в бюретке немного понижается, но потом остаётся постоянным. Если же уровень воды будет понижаться непрерывно, это означает, что прибор пропускает воздух и следует исправить допущенные при сборке дефекты.
Взвесьте 0,07 - 0,09г цинка и поместите в одно из колен пробирки, в другое колено налейте 3 - 5 мл соляной кислоты (1:5). К кислоте добавьте 1 - 2 капли раствора медного купороса (для ускорения взаимодействия цинка с соляной кислотой). Присоедините пробирку к прибору, проверьте прибор на герметичность. Воронку переместите так, чтобы уровни воды в воронке и бюретке совпадали (в этом случае давление газа в приборе будет равно атмосферному). Отметьте и запишите уровень воды в бюретке. После этого поверните пробирку так, чтобы кислота перелилась в колено пробирки с металлом. Водород, выделяющийся в результате взаимодействия металла с кислотой, вытесняет из бюретки воду. Когда весь металл растворится, прекратится понижение уровня воды в бюретке. После окончания реакции дайте пробирке остыть до комнатной температуры, после чего снова приведите воду в бюретке и в воронке к одинаковому уровню. Отметьте и запишите уровень воды в бюретке, а также показания комнатного термометра и барометра.
Экспериментальные данные
Навеска металла - m, г
Объём вытесненного водорода при условиях опыта - V, мл
Температура опыта - t, С
Атмосферное давление - P, мм. рт. ст
Давление насыщенного пара воды при температуре опыта - h, мм. рт. ст.
Рассчитайте эквивалент металла двумя путями:
а) применив уравнение Менделеева-Клапейрона (учесть при этом парциальное давление паров воды), вычислите массу водорода, затем на основании закона эквивалентов рассчитайте эквивалент металла;
б) вычислив объём выделившегося водорода при нормальных условиях, рассчитайте эквивалент металла, используя закон эквивалентов (при этом иметь в виду, что эквивалент водорода занимает объём 11,2 л).
Рассчитайте теоретический эквивалент металла и вычислите абсолютную ошибку опыта:
Абсолютная ошибка = Этеор. – Ээксп.
Вычислите относительную ошибку опыта в процентах:
Относительная
ошибка =
![]() .
.
Опыт 3.2. Определение эквивалента карбоната калия
В данной работе карбонат калия взаимодействует с избытком кислоты. Измерив объём углекислого газа, выделившегося в результате реакции, можно вычислить эквивалент взятого вещества, так как эквивалент карбоната образует при действии кислоты эквивалент, т.е. 11.2 л CO2 (при нормальных условиях).
Определение производят в приборе, изображённом на рис. 3.2. Прибор состоит из двух сообщающихся друг с другом стеклянных трубок, закреплённых в штативе вертикально. Одна трубка (1) градуирована и закрыта пробкой, соединённой каучуковой трубкой (2) с пробиркой (3). Конец второй трубки (4) открыт. Трубки наполнены насыщенным раствором поваренной соли, в котором растворимость углекислого газа меньше, чем в воде. Для определения эквивалента K2CO3 сначала проверьте прибор на герметичность. После проверки прибора установите солевой раствор в градуированной трубке (1) на нулевом делении. В одно колено пробирки при помощи воронки налейте 1 - 1,5 мл 30%-го раствора серной кислоты. Пробирку слегка наклоните и насыпьте во второе колено взвешенный с точностью до 0,01 г порошок прокаленного карбоната калия (0,25 - 0,30г). Пробирку плотно закройте пробкой, затем осторожно приведите в соприкосновение кислоту с карбонатом калия. Наблюдается выделение и накопление CO2 в градуированной трубке.
По окончании реакции приведите солевой раствор в трубках к одинаковому уровню, опуская открытую трубку. Запишите новое положение уровня жидкости в градуированной трубке, а также давление и температуру опыта.
Объём выделившегося углекислого газа приведите к нормальным условиям и рассчитайте эквивалент карбоната калия.
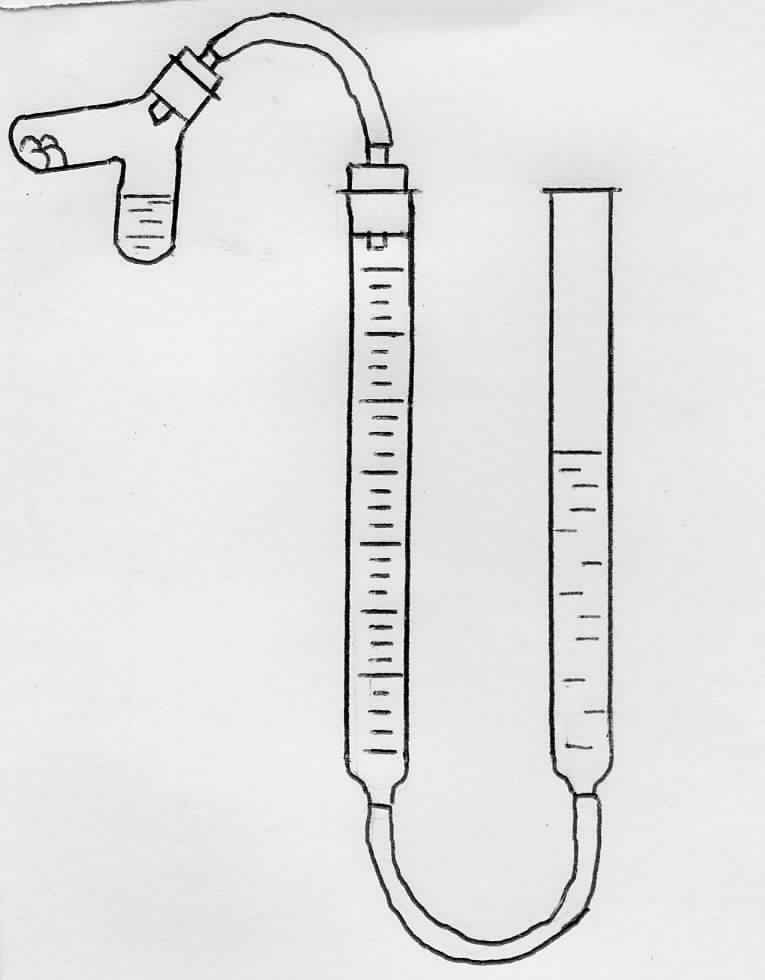
Рис. 3.2. Прибор для определения эквивалента сложных веществ
Экспериментальные данные
Навеска карбоната калия - m, г
Объём выделившегося газа - V, мл
Температура опыта - t, С
Атмосферное давление -P, мм. рт. ст
Рассчитайте эквивалент карбоната калия, абсолютную и относительную ошибки опыта.
