- •1.Предмет молекулярной физики. Основные экспериментальные факты, свидетельствующие о дискретном строении вещества. Тепловое движение с точки зрения молекулярных представлений
- •3.Статистические закономерности и описание системы многих частиц. Макроскопические и микроскопические состояние системы.
- •4. Тепловое равновесие систем. Условия равновесия. Тепловое равновесие систем. Условия равновесия.
- •5.Тепловое равновесие систем. Условия равновесия.
- •6.Молекулярная теория давления идеального газа.
- •7.Принципы конструирования термометра.
- •8.Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева).
- •9.Распределение Максвелла. Характерные скорости молекул.
- •10.Распределение Больцмана. Барометрическая формула.
- •11.Столкновение молекул в газе. Длина свободного пробега. Частота соударений.
- •12.Понятие термодинамического равновесия. Обратимые и необратимые процессы.
- •13.Первое начало термодинамики. Теплоемкость системы. Теплоемкость идеального газа. Связь теплоемкости газа с числом степеней свободы молекул.
- •14.Преобразование теплоты в работу. Нагреватель, рабочее тело, холодильник. Коэффициент полезного действия. Тепловой двигатель и холодильная машина. Цикл Карно и его кпд.
- •15.Второе начало термодинамики. Формулировка Клаузиуса и Томсона (Кельвина). Их эквивалентность.
- •16.Закон возрастания энтропии в неравновесной изолированной системе. Энтропия и вероятность.
- •17.Термодинамическая вероятность. Принцип Больцмана. Статистическая интерпретация второго начала термодинамики.
- •18.Реальные газы. Уравнение Ван-дер-Ваальса. Внутренняя энергия газа Ван-дер-Ваальса.
- •Уравнение состояния
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Критические параметры
- •Приведённые параметры
- •19.Изотермы Ван-дер-Ваальса. Критическое состояние. Область двухфазовых состояний. Метастабильные состояния.
- •20.Коэффициент поверхностного натяжения. Краевой угол. Давление под искривленной поверхностью жидкости.
- •21.Формула Лапласа. Капиллярные явления.
9.Распределение Максвелла. Характерные скорости молекул.
В равновесном состоянии параметры газа остаются неизменными, однако микросостояния – взаимное расположение молекул, их скорости – непрерывно изменяются. Из-за огромного количества молекул практически нельзя определить значения скоростей в какой-либо момент, но возможно, считая скорость молекул непрерывной случайной величиной, указать распределение молекул по скоростям.
Выделим
отдельную молекулу. Хаотичность движения
позволяет, например, для проекции
скорости ![]() молекулы принять нормальный
закон распределения.
В этом случае, как показал Дж.К.Максвелл,
плотность вероятности записывается
следующим образом:
молекулы принять нормальный
закон распределения.
В этом случае, как показал Дж.К.Максвелл,
плотность вероятности записывается
следующим образом:
![]()
Где m – масса молекулы, T - термодинамическая температура газа, k- постоянная Больцмана.
Можно получить максвелловскую функцию распределения вероятностей абсолютных значений скорости
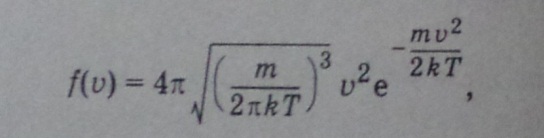
А
также вероятность того, что скорость
молекулы имеет значение, лежащие в
интервале от ![]() до
до![]() :
:
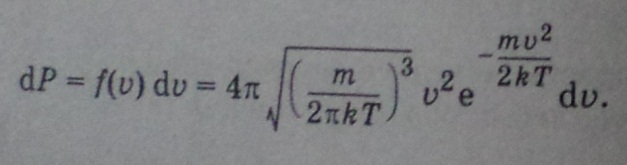
Распределение
одинаково для любой молекулы идеального
газа в заданных условиях(темп.Т).
Оно позволяет вычислить число молекул,
значения скоростей которых лежат в
интервале ![]() .
.
Так
как общее число молекул в газе обычно
велико, то вероятность ![]() равна отношению числа
равна отношению числа ![]() молекул,
скорости которых удовлетворяют условию,
к общему числу
молекул,
скорости которых удовлетворяют условию,
к общему числу ![]() молеку:
молеку:
![]()
Откуда
![]()
Из
чего следует, что
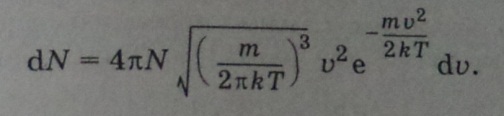 - Выражение является распределением
молекул газа по скоростям (распределение
максвелла).
- Выражение является распределением
молекул газа по скоростям (распределение
максвелла).
С
учетом формулу представим в виде

Скорость соответствующую максимуму кривой Максвелла, называют наивероятнейшей.
Используя
условие максимума функции
![]() или
или
![]()
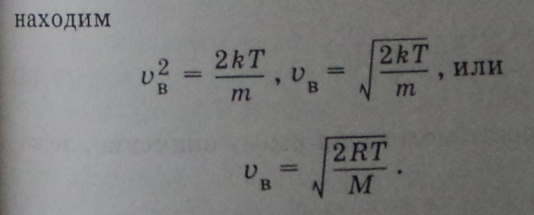
Среднюю скорость (среднее арифметическое значение модулей скоростей) молекул можно найти, поделив сумму скоростей молекул на их число
![]()
При увеличении температуры максимум кривой Максвелла смещается в сторону больших скоростей
Если совершенно точно задана скорость, то интервал скоростей равен нулю и получаем ноль, то есть ни одна молекула не имеет скорости, точно равной наперед заданной.
Распределение молекул по скоростям подтверждено различными опытами.
10.Распределение Больцмана. Барометрическая формула.
|
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекул по скоростям делалось предположение, что внешние силы не действуют на молекулы газа, поэтому молекулы равномерно распределены по объему. Но молекулы любого газа находятся в потенциальном поле тяготения Земли. Сила тяжести, с одной стороны, и тепловое движение молекул — с другой, приводят газ к некоторому стационарному состоянию, при котором давление газа с высотой уменьшается. Выведем закон изменения давления с высотой, предполагая при этом, что масса всех молекул одинакова, поле тяготения однородно и температура постоянна.
Рис.1 Если
атмосферное давление на высоте h равно
р (рис. 1), то на высоте h+dh оно равно p+dp
(при dh>0 dp<0, так как давление с высотой
уменьшается). Разность давлений р и
p+dp равна весу газа, заключенного в
объеме цилиндра высотой dh с основанием
площадью 1 м2:
|