
Координата реакции
Активированный комплекс (АК), активный комплекс. Промежуточный комплекс, образующийся на начальной стадии вза-имодействия активных химических частиц вещества; характери-зуется нестабильностью. Образование АК можно представить схе-мой (рис.39). Расчеты показывают, что протекание реакции через образование АК энергетически выгоднее, чем возникновение новых химических связей после полной диссоциации исход-ных компонентов.
А—А А--------А а А Рис. 40. Изменение энтальпии системы для каталитической (1)
+ _> | | ^ | + | и некаталитической (2) реакций
В-В В В В В Гомогенный катализ. Химический процесс, при котором ка-
Исходные вещества АК Продукты реакции тализатор и реагирующие вещества находятся в одной фазе. На-
пример, разложение пероксида (перекиси водорода) в присут-ствии ионов иода:
н2о2 + I- -> H2O + IO н2о2 + IO --> H2O + I - + O2
Гетерогенный катализ. Химический процесс, при котором катализатор и реагирующие вещества находятся в разных фазах. При гетерогенном катализе реакция протекает на границе разде-ла фаз, а катализатор обычно является твердым телом (К = Pt, Pd, AI2O3, V2O5,). Например,
Рис. 39. Схема образования активированного комплекса
5.2. Катализ
Катализ. Изменение скорости химической реакции под дей-ствием веществ, называемых катализаторами. Различают гомоген-ный, гетерогенный, кислотно-основный катализ.
V2 O 5(t)
2SO2(r) + O2(r) 2SO3.
Катализатор. Вещество, изменяющее скорость химической реакции, способное принимать участие в образовании промежу-точных продуктов, но остающееся после окончания реакции в химически неизмененном виде и в том же количестве. Напри-мер, в системе из двух исходных компонентов А и В действие
108
109
Активные центры катализатора. Поверхностные химические частицы и функциональные группы катализатора, способные адсорбировать химические вещества. Как правило составля-ют небольшую долю поверхности катализатора. Проявляются при гетерогенном катализе.
Кислотно-основный катализ. Химическая реакция, в которой роль катализатора выполняют кислоты и основания.
Каталитические яды. Химические вещества, частично или полностью подавляющие активность катализаторов. Как правило, к ним относятся вещества, “отравляющие” катализатор даже при незначительном содержании их в сырье. Действие каталитических ядов заключается в хемосорбции их на активных центрах катализатора. Отравление катализатора обратимо. Он может быть восстановлен обработкой другими веществами. Действие катали-тических ядов специфично для определенного катализатора.
5.3. Химическое равновесие
Равновесные реакции, обратимые реакции. Химический процесс, характеризующийся протеканием прямой и обратной реакций с одинаковыми скоростями при постоянных термоди-намических условиях. На рис.41 показано изменение концентра-ций реагентов в химической системе во времени при Т= 720 К.
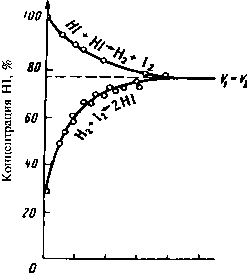
20 40 SO 80 WO "Тремя мин
Рис. 41. Ход реакции образования и распада HI при 720 К
В обратимых химических реакциях исходные вещества образуют продукты реакции, которые могут распадаться или взаимодействовать между собой, снова образуя исходные вещества.
В уравнениях обратимых химических реакций вместо знака равенства ставят две противоположно направленные стрелки. Например:
® -
2NH
N2 + 3H2
PCI5 PCI3 + CI2
Обратимые химические реакции протекают не до конца.
Необратимые реакции, неравновесные реакции. Химические процессы, протекающие в одном направлении практически до полного расходования исходных веществ:
CaCO3 + 2HCI -> CaCI2 + H2O + CO2Т
2KCIO3 -> 2KCI + 3O2 Г
BaCI2 + H2SO4 ^BaSO4i + 2HCI
Стрелками указывают удаление продуктов из сферы реакции (Т - вверх— в виде газов, I - вниз— выпадение осадка).
Химическое равновесие. Состояние химической системы, при котором скорости прямой и обратной реакций равны. Химическое равновесие является динамическим, так как в состоянии равновесия прямая (v1) и обратная (v2) реакции не прекращаются, а продолжают идти с равными скоростями.
2HI h2 + I2
Равновесная концентрация. Концентрация реагента или продукта реакции в состоянии химического равновесия. В состоянии динамического равновесия равновесные концентрации при неизменных термодинамических условиях постоянны.
Константа химического равновесия. Постоянная для дан-ной температуры и давления величина, характеризующая равновесие в химической системе. Численно равна отношению констант скоростей прямой и обратной реакции. Рассмотрим простую реакцию:
Н2 + CI2 2HCI
Используя закон действующих масс, запишем выраже ние для скорости прямой (v1) и обратной (v2) реакций: v1 = k1 [H2] [CI2], v2= k2 [HCI]2
При равновесии v1 = v2, следовательно: k1 [H2] [CI2] = k2 [HCI]2
110
111
Поскольку константы скорости k1 и k2 при данных темпе-ратуре и давлении не меняются, то и их отношение также будет постоянной величиной, называемой константой химического равновесия (К):
K
k1 [HCl]2
k2 [H2 ][Cl2 ]
со
Гетерогенное равновесие. Равновесие в химической системе, в которой реагирующие вещества находятся в разных фазах, например:
С +0
твердое газ газ
тело В этом случае константа равновесия в окончательном виде запишется следующим образом:
[CO2
K/
K
[ CO2
[C][O2
× [ O2]
т.к. [C] для данной системы практически не влияет на скорость реакций.
Смещение равновесия, сдвиг равновесия. Смещение хими-ческого равновесия при изменении внешних условий. Качественно оценивается на основе принципа Ле-Шателъе.
Принцип Ле-Шателье. Если на равновесную химическую систему оказывается внешнее воздействие за счет изменения температуры, давления или концентрации, то равновесие в систе-ме смещается в сторону протекания процессов, которые уменьша-ют вышеуказанные воздействия (если такое смещение возможно).
1. Влияние повышения температуры (Т) на равновесную реакцию состоит в смещении равновесия в сторону протекания эндотермической реакции, а при понижении температуры - в сто- рону протекания экзотермической реакции. Например:
2SO2 (г)+ 02(г) 2SO3 (г) + Q, DН° = -791,6 кДж
При увеличении Т равновесие реакции смещается влево; при уменьшении Т равновесие реакции смещается вправо.
2. Для реакции с участием газообразных веществ по вышение давления приводит к увеличению числа молекул в единице объема. Следовательно, в этом случае равновесие
сместится в сторону уменьшения числа молекул, т.е. в сторону реакции, протекающей с образованием газообразных веществ, занимающих меньший объем. Нап®имер:
2Н2 + 02 2Н20
Смещение равновесия: вправо - при повышении давле-ния, влево - при понижении давления.
3. Влияние концентрации веществ на равновесную систему. Увеличение концентрации веществ смещает равновесие в сто-рону их расходования, а уменьшение - в сторону их образования. Например:
СО + Н20(пар) С02 + Н2
При увеличении концентрации СО и Н20 равновесие реакции сдвигается вправо, а при уменьшении концентрации этих компонентов - влево. Бывают ситуации, когда при внеш-нем воздействии на систему смещения равновесия не наблюда-ется. Например:
Н2 + СI2 2HCI
Для этой реакции объемы исходных веществ и продуктов реакции равны. Поэтому изменение давления для данной систе-мы не вызовет смещения равновесия.
Введение в систему катализатора, как правило, не вызы-вает смещения равновесия, так как катализатор обычно изменя-ет скорость прямой и обратной реакций в одинаковое число раз.
Принцип Ле-Шателье справедлив и для условно равно-весных природных систем, в том числе экологических. Для био-сферы действие указанного принципа обеспечивает сохранение ее устойчивости и стабильности. Однако в последнее время на-блюдается все больше примеров нарушения данного принципа. Одним из подтверждений этого является усиление процессов опустынивания на нашей планете.
112
113
