
Занятие 3 Сопряженные системы
В простейшем случае сопряженные системы – это системы с чередующимися двойными и одинарными связями.
Ковалентная связь считается локализованной, если её электронная пара находится в поле двух ядер и связывает только два атома.
Делокализованная связь – связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи).
Такая делокализация (рассредоточение) электронов характерна для сопряженных π-связей, т.е. кратных связей, чередующихся с одинарными.
Сопряженная система |
|
Несопряженная система |
|
|
|
делокализованные π-связи |
|
локализованные π-связи |
Рассредоточение электронов – энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации π-электронов является π-перекрывание р-атомных орбиталей соседних sp2- или sp-гибридных атомов углерода, лежащих в одной плоскости. С помощью атомно-орбитальной модели можно показать, как происходит делокализация π-связей в молекуле бутадиена-1,3 (рис.1).
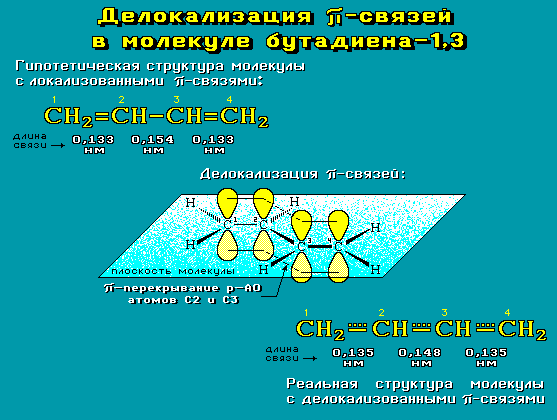
Рис.1 Делокализация π-связей в молекуле бутадиена-1,3
Энергия сопряжения бутадиена-1,3 составляет 15 кДж/моль.
Делокализация π-электронов приводит к тому, что в сопряженной системе связи становятся нецелочисленными (дробными), т.е. ни двойными или тройными, ни одинарными. Иначе говоря, связи имеют нецелочисленный порядок. Соответственно, длины делокализованных связей имеют промежуточные значения между длинами одинарных и кратных связей.
Сопряженные системы могут быть открытыми или замкнутыми (закрытыми) (рис. 2).
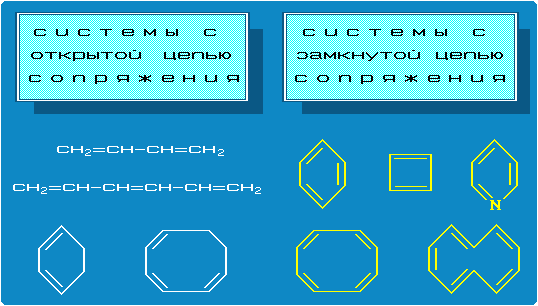
Рис.2 Примеры систем с открытой и замкнутой цепью сопряжения
Типичным примером делокализации связей в циклической молекуле является бензол C6H6 (рис. 3). Энергия сопряжения бензола – 228 кДж/моль.
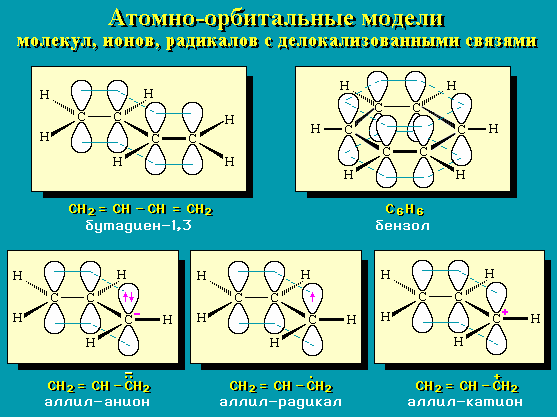
Рис.3 Делокализация связей в молекуле бензола
Виды сопряжения
Сопряженная система может содержать только атомы углерода (рис. 1-3, рис. 4, соединение I), а может содержать на ряду с атомами углерода гетероатомы с неподеленной электронной парой (N, O, S, Cl и т.д.) (рис. 4, соединения II и III):
![]()
I II III
Рис.4 Виды сопряженных систем
В зависимости от того какие атомы входят в сопряженную систему различают следующие виды сопряжения:
,-сопряжение – происходит делокализация только электронов π-связей (рис. 1, рис. 3).
Признаки наличия , -сопряжения в соединении:
1) наличие 2-х и более кратных связей;
2) чередование кратных и одинарных связей.
p,-сопряжение – происходит делокализация электронов π-связей с р-электронами (неподеленной электронной парой (рис. 4 – формулы I, II; рис. 5), неспаренным электроном (рис. 4, формула III)) или с вакантной р-атомной орбиталью (рис. 4, формула IV).
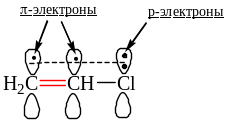
Рис.5 p, -Сопряжение в молекуле хлорэтена
Признаки наличия р,-сопряжения в соединении:
наличие хотя бы одной кратной связи;
наличие гетероатома;
гетероатом непосредственно связан с углеродом, который образует кратную связь;
если гетероатом сам образует двойную связь, то в р,-сопряжении он участвовать не может.
