
- •Введение Общие рекомендации для подготовки к лабораторным занятиям
- •Лабораторная работа №_____ Тема:________________________________________________
- •Классификация неорганических веществ по составу
- •Неметалл
- •Классификация бинарных соединений
- •Классификация оксидов по составу
- •1.2.2. Трехэлементные соединения с кислородом и водородом (гидроксисоединения)
- •Классификация гидроксисоединений и их производных – солей
- •Список традиционных названий оксокислот и солей Таблица 4
- •2.Классификация веществ по типу химической связи и физическим свойствам
- •Классификация кристаллов по типу химической связи
- •Диссоциация воды. Водородный и гидроксильный показатели
- •5. Классификация неорганических веществ по кислотно-основным свойствам
- •5.1. По кислотно-основным свойствам неорганические соединения подразделяют:
- •Основание
- •Кислота
- •Амфотерное соединение
- •Кислота Основание Основание Кислота
- •5.2. Взаимодействие оксидов и гидроксисоединений с водой
- •5.3. Реакция нейтрализации
- •Например:
- •5.3.4. Закономерности изменения кислотно-основных свойств оксидов
- •Сравнительная характеристика свойств оксидов металлов и неметаллов
- •Генетическая связь между классами неорганических соединений
- •5.4. Гидролиз солей
- •Факторы, влияющие на гидролиз соли
- •6.Основные способы получения оксидов и гидроксидов
- •6.1. Способы получения оксидов
- •6.2. Способы получения гидроксидов
- •7. Лабораторные работы по теме:
- •7.1. Лабораторная работа № 1.
- •Задание 1.4.23 Сумма коэффициентов в молекулярном уравнении реакции
- •7.2. Лабораторная работа № 2.
- •7.3. Лабораторная работа № 3
- •7.4. Лабораторная работа № 4
- •8. Окислительно-восстановительные процессы
- •Основные понятия
- •Направление протекания окислительно-восстановительных реакций
- •8.3. Химические свойства металлов
- •8.3.1. Ряд стандартных окислительно-восстановительных потенциалов металлов
- •8.3.2. Взаимодействие металлов с водой
- •8.3.3. Взаимодействие металлов с водными растворами щелочей
- •8.3.4. Взаимодействие металлов с растворами кислот, окисляющими
- •8.3.5. Взаимодействие металлов с концентрированной серной кислотой
- •8.3.6. Взаимодействие металлов с азотной кислотой
- •8.4. Лабораторная работа № 5
- •Электрохимические процессы
- •9.1. Основные понятия
- •Сравнение процессов в гальванических элементах и электролиза
- •9.2. Гальванический элемент
- •Электрохимическая коррозия
- •I процесс (коррозия с водородной деполяризацией)
- •II процесс (коррозия с кислородной деполяризацией)
- •9.4. Электролиз
- •Электролиз растворов солей
- •Электролиз водного раствора сульфата меди (II) с инертным анодом
- •Ряд разряжаемости катионов на катоде
- •Ряд разряжаемости анионов на аноде
- •9.5. Лабораторная работа № 6
- •Приложение
- •Константы диссоциации некоторых кислот
- •Произведение растворимости некоторых малорастворимых электролитов при 25оС
- •Стандартные окислительно-восстановительные потенциалы
- •Библиографический список
- •Содержание
6.2. Способы получения гидроксидов
Взаимодействие щелочных и щелочноземельных металлов с водой:
2Na + 2H2O → 2NaOH + H2↑
раствор
Для получения щелочей используют электролиз водных растворов хлоридов щелочных или щелочноземельных металлов, например:
электролиз
2 NaCl
+ 2H2О
H2↑
+ 2NaOH
+ Cl2↑
NaCl
+ 2H2О
H2↑
+ 2NaOH
+ Cl2↑
раствор
Растворение оксидов щелочных и щелочноземельных металлов в воде:
CaO + H2O → Ca(OH)2
оксид гидроксид
кальция кальция
(«негашеная известь») («гашеная известь)
Ионно-обменные реакции протекают между растворами электролитов в направлении образования осадков, газов или слабых электролитов. Они могут быть использованы для получения растворимых щелочей, если один из продуктов плохо растворим. Например:
Li2SO4 + Ba(OH)2 → BaSO4↓ + 2LiOH
раствор раствор осадок раствор
Общим способом получения нерастворимых гидроксидов является их осаждение из растворов солей действием щелочей. Исключение составляют не устойчивые при комнатной температуре гидроксиды Ag+, Cu+, Hg+, Au+.
В общем виде реакция может быть описана уравнением
MeCln + nNaOH → Me(OH)n↓ + nNaCl (молекулярное уравнение)
Соли и щелочи – сильные электролиты, в растворе полностью диссоциируют на ионы. Уравнение реакции в ионном виде:
Men+ + nCl- + nNa+ + nOH– → Me(OH)n↓+ nNa+ + nCl– (полное ионное уравнение)
Исключив «неизменившиеся ионы» получим краткое ионное уравнение:
Men+ + nOH– → Me(OH)n↓ (краткое ионное уравнение)
Для осаждения амфотерных гидроксидов применяют растворы слабых оснований, например:
AlCl3 + 3NH4OH → Al(OH)3↓ + 3NH4Cl
Al3+ + 3Cl– + 3NH4OH → Al(OH)3↓ + 3NH43+ + 3Cl–
Al3+ + 3NH4OH → Al(OH)3↓ + 3NH4+
Растворы подразделяют на три группы:
ненасыщенные;
насыщенные;
перенасыщенные.
Насыщенный раствор находится в равновесии с твердой фазой растворяемого вещества. Гетерогенное равновесие «осадок насыщенный раствор»
характеризует константа равновесия.
Если малорастворимый электролит диссоциирует по уравнению
AmBn
mAn+
+ nBm-,
то выражение для константы равновесия
– произведения растворимости (![]() )
– будет иметь вид:
)
– будет иметь вид:
Кравн. = = [An+]m·[Bm-]n,
где [An+], [Bm-] – молярные концентрации ионов An+ и Bm- соответственно, в насыщенном растворе.
Например, для равновесия:
Al(OH)3↓ Al3+ + 3OH-
![]()
В насыщенном растворе малорастворимого электролита произведение концентраций ионов, возведенных в степени, равные стехиометрическим коэффициентам, есть величина постоянная при данной температуре. Она называется произведением растворимости и обозначается символом ПР (табл.2 приложения).
Зная произведение растворимости (ПР), можно вычислить растворимость вещества при данных условиях, т.е. концентрацию насыщенного раствора в [моль/л] и в [г/л].
Растворение дополнительного количества вещества возможно в ненасыщенном растворе, так как его концентрация меньше, чем в насыщенном. Из перенасыщенного раствора осадок образуется, так как его концентрация больше, чем в насыщенном.
Отсюда вытекают два следствия.
Условие растворения осадка. Произведение концентраций (
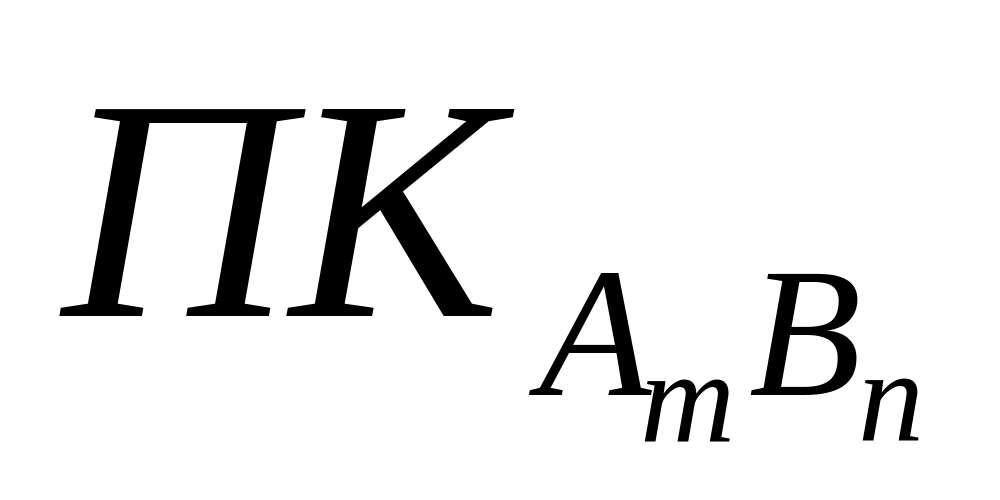 )
ионов, возведенных в степени равные
стехиометричным коэффициентам, должно
быть меньше величины произведения
растворимости:
)
ионов, возведенных в степени равные
стехиометричным коэффициентам, должно
быть меньше величины произведения
растворимости:
![]() =
[An+]m[Bm-]n
<
,
=
[An+]m[Bm-]n
<
,
где [An+], [Bm-] – молярные концентрации ионов в ненасыщенном растворе, соответственно An+ и Bm-.
Условие осаждения осадка. Произведение концентраций (ПКAnBm) ионов, возведенных в степени, равные стехиометричным коэффициентам, должно быть больше величины произведения растворимости:
= [An+]m[Bm-]n > ,
где [An+], [Bm-] – молярные концентрации ионов в перенасыщенном растворе, соответственно An+ и Bm-.
Таким образом, осадки гидроксидов Me(OH)n образуются, если выполняется соотношение
ПКMe(OH)n = [Men+][OH-]n > ПРMe(OH)n,
где [Men+] и [OH-] – молярные концентрации ионов в растворе, соответственно Men+ и OH-.
