
- •Часть II
- •1. Введение
- •1.1. Многообразие углеводородов
- •1.2. Классификация углеводородов
- •2.1. Гомологический ряд алканов
- •2.2. Строение алканов
- •2.3. Изомерия алканов
- •2.3.1. Структурная изомерия алканов
- •2.3.2. Поворотная изомерия алканов
- •2.3.3. Зеркальная (оптическая) изомерия
- •2.4. Номенклатура
- •2.4.1. Радикалы в ряду алканов
- •2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
- •2.4.3. Назовем соединение по номенклатуре июпак
- •2.5. Химические свойства алканов
- •2.5.1. Крекинг алканов
- •2.5.2. Изомеризация алканов
- •2.5.3. Дегидрирование алканов
- •2.5.4. Реакции окисления алканов
- •2.5.5. Реакции замещения
- •2.6. Галогеналканы
- •2.7. Получение алканов
- •2.8. Применение алканов
- •3.1. Изомерия циклоалканов
- •3.2. Свойства циклоалканов
- •3.3. Получение циклоалканов
- •I. Br2, h; II. Br2 (вода); III. HCl; IV. KMnO4 (водн. Р-р).
- •6. Какие соединения образуются при действии металлического натрия на следующие вещества:
- •4. Алкены
- •Vrml-модель (2 камеры, 109300 байт).
- •Vrml-модель (37448 байт)
- •4.2. Номенклатура алкенов
- •2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
- •4.3. Изомерия алкенов
- •4.3.1. Структурная изомерия алкенов
- •4.3.2. Пространственная изомерия алкенов
- •Vrml-модель
- •4.4. Свойства алкенов
- •4.4.1 Реакции присоединения к алкенам
- •4.4.1.1. Гидрирование (присоединение водорода)
- •4.4.1.2. Галогенирование (присоединение галогенов)
- •4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов)
- •4.4.1.5. Полимеризация алкенов
- •4.4.2. Реакции окисления алкенов
- •4.4.3. Изомеризация алкенов
- •4.5. Получение алкенов
- •4.6. Применение алкенов
- •4.7. Контрольные вопросы
- •1. Какие модели соответствуют молекулам алкенов?
- •Тройная связь в ацетилене
- •6.2. Номенклатура алкинов
- •6.3. Изомерия алкинов
- •6.4. Свойства алкинов
- •6.4.2. Образование солей
- •6.4.3. Окисление алкинов
- •6.5. Получение алкинов
- •7.1. Строение бензола
- •Cтроение бензола
- •7.2. Гомологи бензола. Номенклатура и изомерия
- •7.3. Свойства аренов
- •7.3.1. Реакции замещения в бензольном кольце
- •1. Галогенирование
- •2. Нитрование
- •7.3.2. Замещение в алкилбензолах
- •7.3.3. Реакции присоединения к аренам
- •7.3.4. Реакции окисления аренов
- •7.4. Получение ароматических углеводородов
- •7.5. Применение ароматических углеводородов
- •9. Заключение. Генетическая связь между углеводородами
- •4.5. Получение алкенов
7.3.2. Замещение в алкилбензолах
Гомологи бензола (алкилбензолы) С6Н5–R более активно вступают в реакции замещения по сравнению с бензолом.
Например, при нитровании толуола С6Н5CH3 (70С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола:
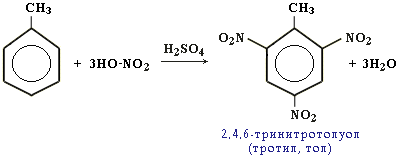
При бромировании толуола также замещаются три атома водорода:
![]()
Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6:
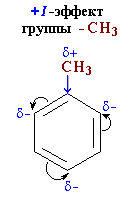
и облегчает замещение именно в этих положениях.
Взаимное влияние атомов определяет направление реакций электрофильного замещения в гомологах бензола и его производных – правила ориентации.
С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4 (раздел 2.5.5).
Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
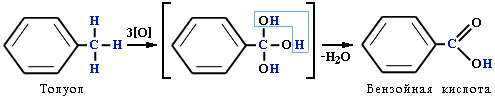
Легче, чем в алканах, протекают реакции радикального замещения в боковой цепи алкилбензолов:
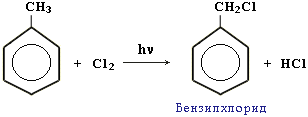
Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (СН3, СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с -электронной системой бензольного кольца.
Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле С6Н6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя.
Правила ориентации
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода. Ориентанты 1-го рода (орто-пара-ориентанты) направляют последующее замещение преимущественно в орто- и пара-положения. К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); -OH (+M,-I); -OR (+M,-I); -NH2 (+M,-I); -NR2 (+M,-I) +M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов. Пример:
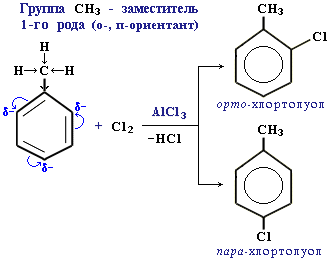
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства: -F (+M<–I), -Cl (+M<–I), -Br (+M<–I). Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение. К ним относятся электроноакцепторные группы:
-NO2 (–M, –I); -COOH (–M, –I); -CH=O (–M, –I); -SO3H (–I); -NH3+ (–I); -CCl3 (–I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше. Пример:
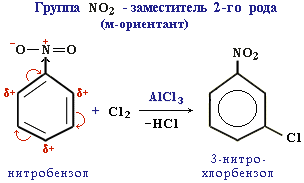
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2.
