
- •«Органическая химия и вмс»
- •Сыктывкар, 2009 введение
- •1 Техника безопасности при работе в лаборатории органической
- •1.1 Общие правила работы
- •1.2 Работа с взрывоопасными и горючими веществами
- •1.3 Общие методические советы
- •2 Методы очистки органических соединений
- •2.1 Очистка твердых органических соединений методом перекристаллизации
- •2.2 Очистка твердых органических соединений методом возгонки
- •2.3 Определение температуры плавления
- •2.4 Очистка жидких органических соединений
- •2.4.1. Простая перегонка
- •2.4.2. Дробная (фракционная) перегонка
- •3. Определение показателя преломления
- •Контрольные вопросы по теме «Методы очистки органических соединений»
- •Методика синтезов на основе реакций нуклеофильного замещения
- •2. Реакции ацилирования
- •Качественный функциональный анализ органических соединений
- •1. Углеводороды
- •Восстановление альдегидами соединений двухвалентной меди.
- •Свойства муравьиной кислоты
- •6. Сложные эфиры
- •Углеводороды
- •Контрольные вопросы по теме «Углеводороды»
- •Галогенпроизводные углеводородов
- •Контрольные вопросы по теме «Галогенпроизводные углеводородов»
- •Соединения, содержащие гидроксигруппу
- •Контрольные вопросы по теме «Соединения, содержащие гидроксигруппу»
- •Карбонильные соединения
- •Контрольные вопросы по теме «Карбонильные соединения»
- •Углеводы
- •Контрольные вопросы по теме
- •Карбоновые кислоты и их производные
- •Контрольные вопросы по теме «Карбоновые кислоты и их производные»
- •Ароматические амины
- •Контрольные вопросы по теме «Ароматические амины» Ароматические амины
- •Рекомендуемая литература к лабораторным работам
Восстановление альдегидами соединений двухвалентной меди.
К 1 мл раствора исследуемого альдегида добавляют половинный объем разбавленного раствора щелочи и затем по каплям раствор сульфата меди до образования осадка. Полученную смесь нагревают до начала кипения, при этом осадок изменяет свою окраску.
Сульфат меди при взаимодействии со щелочью образует голубой осадок гидроксида меди (II). Cu(OH)2. При нагревании этот гидроксид теряет воду и дает черного цвета оксид меди СuО.
Альдегиды легко окисляются до соответствующих карбоновых кислот, т.е. являются сильными восстановителями. При нагревании в щелочном растворе они восстанавливают соединения двухвалентной меди до соединений одновалентной меди и далее до металлической меди по схеме:
Сu(ОН)2
![]() СuОН
СuОН
голубого
цвета желтого цвета ![]()
![]()
![]() Сu
Сu
коричневато – красного цвета
СuО
Сu2О
![]()
черного
цвета ![]() красного цвета
красного цвета
Ход реакции легко можно проследить по изменению цвета осадка. Эта реакция была предложена Троммером. Избыток свободной щелочи резко ускоряет окисление альдегидов.
В условиях данного опыта уксусный альдегид восстанавливает соединения двухвалентной меди до соединений Сu (I):
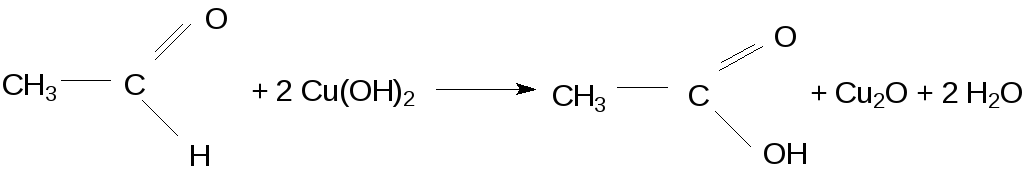
Формальдегид же не только непосредственно окисляется, но в присутствии Сu2О как катализатор взаимодействует со щелочью:

Образующийся при этом водород восстанавливает соединения меди до металла.
Образование йодоформа из альдегидов и кетонов
К 1 – 2 мл разбавленного водного раствора исследуемого вещества добавляют 1 мл раствора йода КI и затем несколько капель раствора щелочи до исчезновения окраски. В некоторых растворах немедленно и без нагревания образуется желтый осадок йодоформа.
Реакции образования йодоформа из спиртов. Подробно рассмотренная выше (см. опыт 12). требует нагревания. Промежуточной ее стадией является образование альдегида (или кетона) в результате окисления спирта. Получение же йодоформа непосредственно из альдегида или кетона, в молекуле которого уже имеется группировка СН3 – СО -, протекает гораздо быстрее даже при обычной температуре, так как фаза окисления в этом случае даже отпадает. Вследствие ничтожной растворимости йодоформа в воде реакция эта очень чувствительная и позволяет, например, обнаружить содержание в воде 0,04% ацетона.
Химизм процесса получения йодоформа из ацетона следующий:
J2
+ 2 NaOH ![]() NaOJ + NaJ + H2O
NaOJ + NaJ + H2O
O O
![]()
![]()
CH3– C – CH + 3 NaOJ![]() CH3– C – CJ3+ 3 NaOH
CH3– C – CJ3+ 3 NaOH
O O
![]()
![]()
CH3
– C – CJ2
+ NaOH ![]() CH3
– C – ONa + CHJ3
CH3
– C – ONa + CHJ3
Формальдегид не содержит в молекуле необходимой для образования йодоформа группировки атомов и в условиях опыта окисляется до муравьиной кислоты.
Реакция с 2,4 – динитрофенилгидразином. Альдегиды и кетоны можно обнаружить по образованию 2,4 – динитрофенилгидразонов, выделяющихся в виде ярко – желтых или красных осадков, мало растворимых в воде:
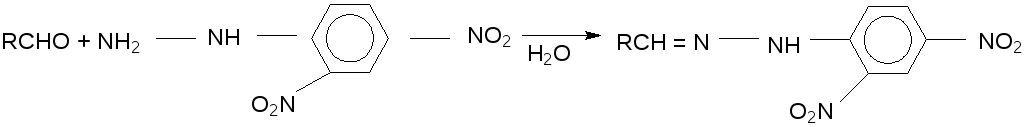
В пробирку к 1 мл гидрохлорида или сульфата 2,4 – динитрофенилгидразина добавляют раствор 0,1 г (или 1 мл) анализируемого вещества в спирте. Смесь нагревают на водяной бане. При охлаждении выделяется желтый или красный осадок 2,4 – динитрофенилгидразона карбонильного соединения.
Кислоты
Определение кислотности. Водно – спиртовые растворы карбонильных кислот показывают кислую реакцию на лакмус, конго красный или универсальный индикатор.
Каплю водно- спиртового раствора исследуемого вещества наносят на синюю влажную бумажку лакмуса, Конго или универсального индикатора. При наличии кислоты индикатор меняет свой цвет: лакмус становится розовым, Конго – синим, а универсальный индикатор в зависимости от кислотности от желтого до оранжевого.
Следует иметь в виду, что сульфокислоты, нитрофенолы и некоторые другие соединения с подвижным « кислым» водородом, не содержащие карбоксильной группы, могут давать также изменение цвета индикатора.
Реакция с гидрокарбонатом натрия. При взаимодействии карбоновых кислот с гидрокарбонатом натрия происходит выделение оксида углерода.
R COOH
+ NaOH RCOONa
+ H2O
+ CO2
COOH
+ NaOH RCOONa
+ H2O
+ CO2
В пробирку наливают 1 – 2 мл насыщенного раствора гидрокарбоната натрия и добавляют 1 – 2 мл водно – спиртового раствора исследуемого вещества. Пробирку закрывают газоотводной пробкой, конец трубки которой опущен в пробирку с баритовой ( известковой) водой. При выделении углекислого газа в пробирке с баритовой водой образуется белый осадок, что указывает на наличие кислоты в исходном соединении.
