
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
- •Рецензент:
- •А) изготовление простого фильтра;
- •Лабораторная работа № 18 Тема: методы очистки и выделения органических соединений. Перекристаллизация
- •18.1 Теоретическая часть
- •18.2 Экспериментальная часть
- •Лабораторная работа № 19 Тема: методы очистки и выделения органических соединений. Сублимация
- •19.1 Теоретическая часть
- •19.2. Экспериментальная часть
- •Лабораторная работа № 20 Тема: методы очистки и выделения органических соединений. Перегонка
- •20.1 Теоретическая часть
- •20.2. Экспериментальная часть
- •20.3. Отчет о работах №18-20
- •20.4. Контрольные вопросы
- •Лабораторная работа № 21 Тема: качественный элементный анализ органических соединений
- •21.1 Теоретическая часть
- •21.2 Экспериментальная часть
- •21.2.1 Обнаружение углерода пробой на обугливание (тяга !).
- •21.2.2 Обнаружение углерода и водорода окислением вещества оксидом меди (II).
- •21.2.3 Проба Бейльштейна на галогены.
- •21.2.4 Обнаружение галогенов действием натрия на спиртовой раствор органического вещества.
- •21.3 Отчет о работе
- •22.1.2 Химические свойства
- •22.2 Экспериментальная часть
- •22.2.3 Бромирование предельных углеводородов
- •22.3. Отчет о работе
- •22.4. Контрольные вопросы
- •22.5. Индивидуальное задание
- •23.1.2 Химические свойства
- •5. Окисление перманганатом калия в нейтральной или слабощелочной среде приводит к образованию гликолей.
- •Реакция часто применяется для определения положения двойной связи в молекуле, так как по образующимся карбонильным соединениям можно представить себе и строение исходного алкена.
- •23.2 Экспериментальная часть
- •23.2.1 Получение этилена и его горение
- •23.2.2 Присоединение к этилену брома
- •23.2.3 Отношение этилена к окислителям
- •23.2.4 Бромирование непредельных углеводородов
- •23.3 Отчет о работе
- •23.4. Контрольные вопросы
- •Лабораторная работа № 24 Тема: алкины
- •24.1 Теоретическая часть
- •24.1.1 Методы получения
- •24.1.2 Химические свойства
- •А. Реакции присоединения
- •5. Присоединение спиртов. В присутствии едкого кали под давлением ацетилен присоединяет спирты с образованием алкилвиниловых эфиров:
- •24.2 Экспериментальная часть
- •24.3 Отчет о работе
- •24.4. Контрольные вопросы
- •24.5. Индивидуальное задание
- •1. Получение бензола из ацетилена:
- •3. Из ароматических соединений:
- •4. Гомологи бензола получают из галогенпроизводных реакцией Вюрца-Фиттига:
- •25.1.2 Химические свойства
- •25.2 Экспериментальная часть
- •25.2.1 Окисление ароматических углеводородов
- •25.2.2 Бромирование ароматических углеводородов
- •25. 2.3. Алкилирование бензола.
- •25.3 Отчет о работе
- •25.4. Контрольные вопросы
- •Лабораторная работа №26 Тема: спирты и фенолы
- •26.1Теоретическая часть
- •26.1.1 Методы получения спиртов
- •26.1.2 Химические свойства спиртов
- •1. Взаимодействие с щелочными металлами:
- •26.1.3 Методы получения фенолов
- •26.1.4 Химические свойства
- •26.2 Экспериментальная часть
- •26.2.1 Обнаружение воды в спирте и обезвоживание спирта
- •26.2.2 Свойства изоамилового спирта
- •26.2.3 Отношение спиртов к индикаторам
- •26.2.4 Окисление этилового спирта окисью меди
- •26.2.5 Растворение фенола в воде
- •26.2.6 Получение фенолята натрия
- •26.2.7 Получение трибромфенола
- •26.3. Отчет о работе
- •26.4. Контрольные вопросы
- •Лабораторная работа №27 Тема: альдегиды и кетоны
- •27.1 Теоретическая часть
- •27.1.1 Методы получения
- •3. В технике альдегиды получают прямым присоединением со и н2 к олефинам:
- •27.1.2 Химические свойства альдегидов и кетонов
- •4. Присоединение спиртов:
- •6. Взаимодействие с аммиаком:
- •7. Образование оксимов с гидроксиламином:
- •27.2 Экспериментальная часть
- •27.2.1 Открытие альдегидов с фуксинсернистой кислотой (Реакция Шиффа)
- •27.2.2 Цветная реакция на ацетон с нитропруссидом натрия (Проба Легаля)
- •27.2.3 Окисление формальдегида аммиачным раствором оксида серебра (реакция Толленса)
- •27.2.4 Окисление формальдегида гидроксидом меди (II) в щелочной среде
- •27.3. Отчет о работе
- •27.4. Контрольные вопросы
- •27.5. Индивидуальное задание лабораторная работа №28 Тема: карбоновые кислоты
- •28.1 Теоретическая часть
- •28.1.3 Химические свойства
- •28.2 Экспериментальная часть
- •28.2.1 Растворимость карбоновых кислот в воде и органических растворителях
- •28.2.2 Получение и свойства муравьиной кислоты
- •28.2.3 Получение и свойства уксусной кислоты
- •28.2.4.Реакции олеиновой и сорбиновой кислот с бромной водой
- •28.2.5.Окисление олеиновой кислоты перманганатом калия
- •28.3. Отчет о работе
- •28.4. Контрольные вопросы
- •28.5. Индивидуальное задание
- •29.2 Экспериментальная часть
- •29.2.1. Гидролиз мыла
- •29.2.2. Выделение высших жирных кислот из мыла
- •29.2.3. Образование нерастворимых солей высших жирных кислот
- •29.2.4. Взаимодействие растительного масла с водным раствором перманганата калия (реакция Вагнера)
- •29.2.5. Омыление жира спиртовым раствором гидроксида натрия
- •29.2.6. Определение кислотного числа, числа омыления и эфирного числа (выполняется в порядке нирс)
- •29.3.Отчет о работе
- •29.4.Вопросы для контроля знаний
- •29.5. Индивидуальное задание
- •30.1.2. Свойства и реакционная способность
- •30.1.3.Применение
- •30.3. Экспериментальная часть
- •30.4. Контрольные вопросы
- •30.5. Индивидуальное задание лабораторная работа №31 Тема:качественные реакции на функциональные группы
- •31.1. Теоретическая часть
- •Простые эфиры – легколетучие жидкости (низшие) с характерным запахом. Качественной реакцией на простые эфиры является реакция с иодистоводородной кислотой:
- •31.2.Экспериментальная часть
- •31.2.1. Содержание задания
- •31.2.2.Ход анализа органических соединений
- •1. Предварительные испытания
- •31.2.3.Проведение некоторых качественныхреакций
- •31.3.Типовые экспериментальные задачи
- •Лабораторная работа №32 Тема:идентификация полимерных материалов
- •32.1.Теоретическая часть
- •32.2.Экспериментальная часть
- •31.3.Отчет о работе
- •Содержание
- •Лукашов Сергей Викторович
27.3. Отчет о работе
Таблица 8 – Химические свойства альдегидов и кетонов
|
№п/п |
Название опыта |
Условия проведения, наблюдения, уравнения реакций |
Вывод |
|
|
|
|
|
27.4. Контрольные вопросы
1.Окислением каких спиртов можно получить следующие соединения: а) 2-метилбутаналь; б) изомасляный альдегид; в) 5,5-диметилгексанон-3; г) метилизобутилкетон?
2. Из каких альдегидов и кетонов при восстановлении могут быть получены следующие спирты: а) 1-пентанол; б) этилпропилкарбинол; в) метилизопропилкарбинол; г) метилтретбутилкарбинол?
3. Какие соединения получатся при действии гидросульфита натрия на: а) пропаналь; б) 2-метилбутаналь; в) метилэтилкетон?
4.Написать уравнение реакции взаимодействия пропионового альдегида с пропанолом-2.
5. Предложить способ распознавания метилпропилкетона и диэтилкетона.
6.Получить реакцией оксосинтеза изомасляный альдегид и написать для него уравнение реакции “серебряного зеркала”.
7.Получите 3-метилпентаналь окислением соответствующего спирта. Напишите для альдегида уравнение реакции с хлоридом фосфора (V).
8.Напишите уравнение альдольной конденсации: а) уксусного альдегида с формальдегидом; б) формальдегида с ацетоном; в) диметилуксусного альдегида.
9. Напишите схемы окисления кетонов: а) бутанона; б) 2-метилпентанона; в) 2,2-диметил-3-гексанона.
10. Предложите химический метод, с помощью которого можно разделить: а)гексаналь и гексан; б) пентаналь и диэтилкетон.
11.Используя в качестве исходного вещества ацетилен, получите 2-бутеналь и напишите для него уравнение реакции с синильной кислотой.
12.Получите метилвинилкетон из следующих веществ: а) ацетона и формальдегида; б) ацетилена и неорганических реагентов.
13. Напишите уравнения реакций в соответствии со следующей схемой: спирт альдегид дигалоидпроизводное альдегид и укажите условия проведения.
14. Написать уравнение реакции Канниццаро для триметилуксусного альдегида.
15. Написать уравнение реакции сложноэфирной конденсации пропаналя.
27.5. Индивидуальное задание лабораторная работа №28 Тема: карбоновые кислоты
Цель работы: Практическое ознакомление с некоторыми общими и специфическими свойствами карбоновых кислот на примере отдельных представителей.
Задания: 1) изучить теоретический материал
2) провести опыты, представленные в экспериментальной части
3) оформить отчет о работе
4) выполнить индивидуальное задание
28.1 Теоретическая часть
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп - СООН.
Карбоновые кислоты классифицируют по числу карбоксильных групп (одноосновные и многоосновные), по количеству атомов углерода (низшие и высшие), в зависимости от строения углеводородного радикала (предельные, непредельные, ароматические, оксикислоты, фенолокислоты, альдегидо- и кетокислоты и другие группы). В соответствии с вышеуказанным различают следующие гомологические ряды карбоновых кислот.
|
Предельные одноосновные кислоты |
Непредельные одноосновные кислоты | ||
|
НСООН |
муравьиная |
СН2=СН-СООН |
Акриловая |
|
СН3СООН |
уксусная |
СН2=СН-СН2-СООН |
Винилуксусная |
|
СН3СН2СООН |
пропионовая |
СН3СН=СНСООН |
кротоновая
|
|
СН3(СН2)2-СООН |
масляная |
СН2=С(СН3)-СООН |
метакриловая |
|
СН3(СН2)3-СООН |
валериановая |
СН3-(СН=СН)2-СООН |
сорбиновая |
|
СН3(СН2)4-СООН |
капроновая |
СН3(СН2)7СН=СН(СН2)7-СООН |
Олеиновая (цис-), элаидиновая (транс-) |
|
СН3(СН2)5-СООН |
энантовая |
С17Н31СООН |
линолевая |
|
СН3(СН2)10-СООН |
лауриновая |
С17Н29СООН |
Линоленовая |
|
СН3(СН2)14-СООН |
пальмитиновая |
СН≡С-СООН |
Пропиоловая |
|
СН3(СН2)16-СООН |
стеариновая |
СН3С=С-СООН |
тетроловая |
|
С20Н31СООН |
арахидоновая |
|
|
Предельные двухосновные кислоты: НООС-СООН – щавелевая, НООС-СН2-СООН – малоновая, НООС-(СН2)2-СООН – янтарная, НООС-(СН2)3-СООН – глутаровая, НООС-(СН2)4-СООН – адипиновая, НООС-(СН2)5-СООН – пимелиновая, НООС-(СН2)6-СООН – пробковая, НООС-(СН2)7- СООН – азелаиновая, НООС-(СН2)8-СООН – себациновая.
Непредельные двухосновные кислоты: НООС-СН=СН-СООН – малеиновая (цис-изомер) и фумаровая (транс-изомер).
Ароматические карбоновые кислоты: одноосновные – С6Н5-СООН –бензойная; СН3-С6Н4-СООН – толуиловые кислоты (орто-, мета-, пара-), двухосновные:

фталевая изофталевая терефталевая
Предельные жирно-ароматические кислоты: С6Н5-СН2-СООН – фенилуксусная.
Непредельные жирно-ароматические кислоты: С6Н5-СН=СН-СООН – коричная
Оксикарбоновые кислоты: одноосновные: НО-СООН – оксимуравьиная, угольная; НО-СН2-СООН – гликолевая; СН3СН(ОН)-СООН – молочная; двухосновные: НООС-СНОН-СООН – тартроновая, НООС-СН2-СНОН-СООН – яблочная, НООС-СНОН-СНОН-СООН – винная;
НООС-СН2-С(ОН)(СООН)-СН2-СООН – лимонная; ароматические оксикислоты (фенолокислоты):

салициловая о-оксикоричная
28.1.1 Методы получения
Карбоновые кислоты встречаются в природе в свободном состоянии (муравьиная кислота – в крапиве, яблочная – в фруктах, сорбиновая – в ягодах рябины, брусники, изовалериановая – в валериановом корне), а также в виде сложных эфиров и жиров. Основным источником получения карбоновых кислот является все же органический синтез.
1. Окисление спиртов, альдегидов, кетонов, углеводородов (см. химические свойства указанных соединений).
2. Оксосинтез:
главное направление
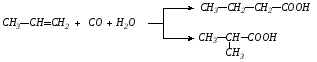
побочное направление
Процесс проводят при высокой температуре и давлении в присутствии карбонилов никеля или кобальта (Ni(CO)4, Co(CO)8).
3. Гидролиз нитрилов (R-C≡N) в кислой или щелочной среде при нагревании:
R-CN + 2H2O R-COOH + NH3
4. Гидролиз тригалогенпроизводных:
R-CBr3 + 2H2O R-COOH + 3HBr
5. Магнийорганический синтез (лабораторные методы):
R-Mg-Br + CO2 R-COOMgBr
R-COOMgBr + HCI R-COOH + MgBrCI
28.1.2 Физические свойства карбоновых кислот
Карбоновые кислоты являются жидкими или твердыми веществами. Алифатические карбоновые кислоты С1-С10 – жидкости. Безводная уксусная кислота затвердевает при 17оС и ее называют ледяной уксусной кислотой. Ароматические кислоты и двухосновные кислоты – кристалличесие вещества с довольно высокими температурами плавления. Температуры кипения и плавления их выше по сравнению со спиртами (с тем же числом атомов углерода), что объясняется значительной ассоциацией молекул за счет более прочных, чем в спиртах, водородных связей. В газовой фазе и в органических растворителях кислоты образуют димеры:

Карбоновые кислоты с достаточно низкой молекулярной массой растворимы в воде. Низшие алифатические кислоты обладают резким запахом. Столовый уксус – это 3-7%-ный раствор уксусной кислоты в воде. Запах масляной кислоты распространяется от прогорклого масла.
