- •Российский национальный исследовательский
- •1. Некоторые основные понятия и законы химии
- •2. Энергетика химических реакций
- •Упражнения и задачи для самостоятельного решения
- •3. Химическое равновесие
- •3.1. Основные понятия и признаки химического равновесия
- •3.2. Смещение химического равновесия
- •Упражнения и задачи для самостоятельного решения
- •4. Растворы
- •4.1. Основные понятия. Образование растворов
- •4.2. Способы выражения состава растворов
- •Задачи для самостоятельного решения
- •5. Равновесия в растворах электролитов
- •Упражнения и задачи для самостоятельного решения
- •6. Растворы сильных электролитов
- •Упражнения и задачи для самостоятельного решения
- •7. Буферные растворы
- •7.1. Основные понятия
- •7.2. Свойства буферных растворов
- •Упражнения и задачи для самостоятельного решения
- •8. Равновесия в системе осадок― раствор
- •Упражнения и задачи для самостоятельного решения
- •9. Строение атома
- •Принципы заполнения атомных орбиталей электронами
- •Упражнения для самостоятельного решения
- •10. Окислительно - восстановительные реакции
- •Окислители и восстановители
- •Составление уравнений окислительно-восстановительных реакций
- •Влияние среды реакции
- •Основные схемы электронно-ионных полуреакций в различных средах
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Реакции самоокисления-самовосстановления
- •Окислительно-восстановительные реакции с участием органических веществ.
- •Упражнения для самостоятельного решения
- •11. Химическая связь
- •11.1. Ковалентная связь Метод валентных связей
- •Механизмы образования химической связи
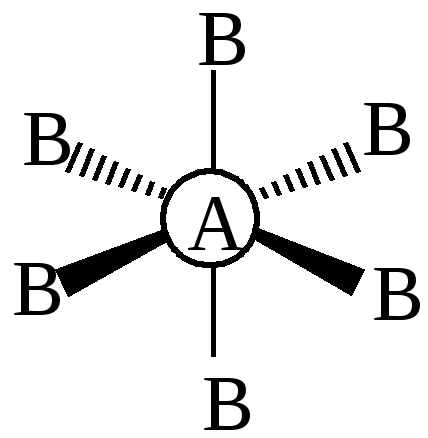
- •Гибридизация атомных орбиталей и геометрия молекул
- •Делокализованная π-связь
- •Метод молекулярных орбиталей
- •Энергетические диаграммы двухатомных частиц, образованных элементами первого периода
- •Гетероядерные двухатомные молекулы образованные элементами разных периодов.
- •Энергетические диаграммы двухатомных частиц, образованных элементами второго периода
- •Многоатомные молекулы
- •Свойства ковалентной связи
- •Насыщаемость
- •Направленность связи
- •Длина и энергия связи
- •Полярность связи
- •11.2. Ионная связь
- •Поляризация и поляризуемость ионов
- •Б) протон, внедряясь в кислородный анион, снижает его заряд и уменьшает деформируемость; поэтому hco3- и hso3- менее устойчивы, чем co32- и so32-
- •Влияние водородной связи на физические и химические свойства водородных соединений.
- •Эти связи часто образуются в хелатных комплексах, как, например, в бис(диметилглиоксимато)никелеIi(см.Рис.29).
- •11.4. Металлическая связь
- •11.5. Межмолекулярные взаимодействия
- •11.6. Химическая связь в твердых телах
- •Упражнения для самостоятельного решения
- •12. Комплексные соединения
- •12.1. Основные понятия
- •12.2. Строение комплексных соединений
- •12.3. Природа химической связи в комплексных соединениях
- •Теория кристаллического поля
- •Теория поля лигандов
- •12.4. Устойчивость комплексных соединений
- •12.5. Свойства комплексных соединений Окраска комплексных соединений
- •Магнитные свойства комплексных соединений
- •Кислотно-основные свойства комплексных соединений
- •Упражнения и задачи для самостоятельного решения
- •Приложение
- •Содержание
Приложение
Таблица 1. Относительная электроотрицательность элементов по Полингу
|
Iгр |
IIгр |
IIIгр |
IVгр |
Vгр |
VIгр |
VIIгр |
VIIIгр |
|
H 2,1 |
|
|
|
|
|
|
|
|
Li 1,0 |
Be 1,5 |
B 2,0 |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
|
|
Na 0,9 |
Mg 1,2 |
Al 1,5 |
Si 1,8 |
P 2,1 |
S 2,5 |
Cl 3,0 |
|
|
K 0,8 |
Ca 1,0 |
Sc 1,3 |
Ti 1,5 |
V 1,6 |
Cr 1,6 |
Mn 1,5 |
Co Ni 1,9 |
|
|
Zn 1,6 |
Ga 1,6 |
Ge 1,8 |
As 2,0 |
Se 2,4 |
Br 2,8 |
|
|
Rb 0,8 |
Sr 1,0 |
Y 1,5 |
Zr 1,5 |
Nb 1,6 |
Mo 1,8 |
Tc 1,9 |
Ru Rh Pd 2,2 |
|
|
Cd 1,7 |
In 1,7 |
Sn 1,8 |
Sb 1,9 |
Te 2,1 |
I 2,5 |
|
|
Cs 0,7 |
Ba 0,9 |
La-Lu 1,0-1,2 |
Hf 1,3 |
Ta 1,5 |
W 1,7 |
Re 1,9 |
Os Ir Pt 2,2 |
|
|
Hg 1,9 |
|
Pb 1,9 |
Bi 1,9 |
Po 2,0 |
At 2,2 |
|
Таблица 2. Длина и энергия разрыва связей
|
|
d пм |
E кДж/моль |
|
D пм |
E кДж/моль |
|
C-H |
109 |
416 |
C=O |
116 |
695 |
|
H-F |
91 |
565,7 |
O-H |
96 |
467 |
|
H-Cl |
127 |
427,8 |
O-O |
148 |
146 |
|
H-Br |
141 |
362,5 |
S-H |
135 |
347 |
|
H-I |
161 |
294,5 |
N-H |
101 |
391 |
|
C-C |
154 |
356 |
As-H |
152 |
247 |
|
C=C |
134 |
528 |
F-F |
141 |
159 |
|
C≡C |
|
813 |
N ≡N |
110 |
941,6 |
Таблица 3. Электрический момент диполя µ некоторых молекул
|
Молекула |
µ∙1029Кл∙м |
Молекула |
µ∙1029Кл∙м |
|
H2 |
0 |
HF |
0,640 |
|
N2 |
0 |
HCl |
0,347 |
|
CO |
0,033 |
HBr |
0,263 |
|
NO |
0,023 |
HI |
0,127 |
Таблица 4 Константы кислотности и основности важнейших протолитических пар в водном растворе при298оК
|
Кислота |
Ka |
pKa |
|
Азотистая HNO2 |
4 10-4 |
3.4 |
|
Борная H3BO3 |
(I)5.8 10-10 (II) 1,8 10-13 (III) 1,6 10-14 |
9,24 12,74 13,80 |
|
Перекись водорода |
(I)2,63 10-12 |
11,58 |
|
Вода |
1,8 10-16 |
15,74 |
|
Мышьяковая H3AsO4 |
(I)5,98 10-3 (II)1,05 10-7 (III)3,89 10-12 |
2,22 6,98 11,41 |
|
Селеноводородная H2Se |
(I)1,7 10-4 (II)1 10-11 |
3,77 11,0 |
|
Сернистая H2SO3 |
(I)1,58 10-2 (II)6,31 10-8 |
1,8 7,2 |
|
Сероводородная H2S |
(I)6 10-8 (II)1 10-14 |
7,2 14,0 |
|
Синильная HCN |
7,2 10-15 |
14,92 |
|
Угольная |
(I)4,45 10-7 (II)4,69 10-11 |
6,35 10,33 |
|
Фосфорная H3PO4 |
(I)7,52 10-3 (II)6,31 10-8 (III)1,26 10-12 |
2,12 7,20 11,9 |
|
Хлорноватистая HclO |
5,01 10-8 |
7,3 |
|
Бензойная C6H5COOH |
6,6 10-5 |
4,18 |
|
Уксусная CH3COOH |
1,75 10-5 |
4,75 |
|
Молочная НОСН(СН3)СООН |
1,37 10-4 |
3б86 |
|
Масляная СН3(СН2)2СООН |
1,52 10-5 |
4,82 |
|
Муравьиная НСООН |
1,77 10-4 |
3,75 |
|
Щавелевая (СООН)2 |
(I)5,4 10-2 (II)5,4 10-5 |
1,27 4,27 |
|
Основание |
Kb |
pKb |
|
Аммиак NH3 H2O |
1,79 10-5 |
4,75 |
|
Al(OH)3 |
(III)1,38 10-9 |
8,86 |
|
Fe(OH)2 |
(II)1,3 10-4 |
3,89 |
|
Fe(OH)3 |
(II)1,82 10-11 (III)1,35 10-12 |
10,74 11,87 |
|
Cd(OH)2 |
(II)5,0 10-3 |
2,30 |
|
Co(OH)2 |
(II)4 10-5 |
4,4 |
|
Mn(OH)2 |
(II)5,0 10-4 |
3,30 |
|
Cu(OH)2 |
(II)3,4 10-7 |
6,47 |
|
Cr(OH)3 |
(III)1,02 10-10 |
9,99 |
|
Zn(OH)2 |
(II)4,0 10-5 |
4,4 |
|
Ni(OH)2 |
(II)2,5 10-5 |
4,6 |
|
Pb(OH)2 |
(I)9,6 10-4 |
3,02 |
Таблица 5. Коэффициенты активности ионов
|
Ионы |
Ионная сила раствора | ||||||||||
|
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
0,05 |
0,1 |
0,2 |
0,3 |
0,5 |
1,0 | |
|
Н3О+ |
0,98 |
0,97 |
0,95 |
0,92 |
0,91 |
0,88 |
0,86 |
0,83 |
0,80 |
0,79 |
0,85 |
|
Li+ |
0,98 |
0,96 |
0,95 |
0,93 |
0,91 |
0,87 |
0,87 |
0,80 |
|
|
|
|
Rb+,Cs+,Ag+ NH4+ |
0,98 |
0,96 |
0,95 |
0,92 |
0,90 |
0,85 |
0,80 |
0,75 |
0,70 |
0,63 |
0,52 |
|
K+,Cl-,Br-, I-,NO2-,NO3- |
0.98 |
0,96 |
0,95 |
0,93 |
0,90 |
0,85 |
0,80 |
0,76 |
0,71 |
0,64 |
0,53 |
|
OH-,F-,CNS-, MnO4-,ClO4- |
0,96 |
0,95 |
0,93 |
0,90 |
0,87 |
0,82 |
0,76 |
0,68 |
0,63 |
0,56 |
0,46 |
|
Na+,H2PO4- |
0,98 |
0,96 |
0,95 |
0,90 |
0,87 |
0,82 |
0,77 |
0,73 |
0,70 |
0,67 |
0,63 |
|
SO42-,CrO42- |
0,90 |
0,87 |
0,80 |
0,74 |
0,66 |
0,55 |
0,45 |
0,36 |
|
|
|
|
Pb2+,CO32-, SO32-,HPO42-, S2O32- |
0,87 |
0,86 |
0,82 |
0,66 |
0,62 |
0,52 |
0,36 |
0,29 |
0.25 |
0,22 |
0,18 |
|
Sr2+,Ba2+,Cd2+, Hg2+,S2- |
0,90 |
0,87 |
0,81 |
0,74 |
0,67 |
0,56 |
0,47 |
0,38 |
0,34 |
0,31 |
0,27 |
|
Ca2+,Cu2+,Zn2+, Fe2+,Mn2+,Ni2+, Co2+ |
0,91 |
0,87 |
0,81 |
0,75 |
0,68 |
0,75 |
0,49 |
0,41 |
0,36 |
0,33 |
0,29 |
|
Mg2+,Be2+ |
0,91 |
0,87 |
0,81 |
0,76 |
0,69 |
0,60 |
0,52 |
0,45 |
0,41 |
0,35 |
0,30 |
|
PO43-, [Fe(CN)6]3- |
0,80 |
0,73 |
0,61 |
0,51 |
0,40 |
0,25 |
0,16 |
0,10 |
|
|
|
|
Al3+,Fe3+,Cr3+ |
0,80 |
0,74 |
0,63 |
0,54 |
0,45 |
0,33 |
0,25 |
0,18 |
|
|
|
Таблица 6 Устойчивость комплексов [MLn]в водном растворе при 250С
(βn-общая константа устойчивости)
|
Центральный Ион |
Лиганд |
N |
lg βn |
|
1 |
2 |
3 |
4 |
|
Ag+ |
NH3 |
2 |
7,24 |
|
|
CN- |
2 |
19,85 |
|
|
Cl- |
2 |
5,04 |
|
Al3+ |
OH- |
4 |
32,51 |
|
|
F- |
6 |
20,83 |
|
Be2+ |
OH- |
4 |
15,00 |
|
|
F- |
4 |
15,00 |
|
Cu2+ |
NH3 |
4 |
12,9 |
|
|
OH- |
4 |
18,5 |
|
Co2+ |
NH3 |
6 |
4,39 |
|
|
NO2- |
4 |
3,1 |
|
|
CN- |
6 |
19,09 |
|
Co3+ |
NH3 |
6 |
35,21 |
|
|
CN- |
6 |
64,0 |
|
Cr3+ |
OH- |
6 |
14,42 |
|
|
NCS- |
6 |
3,80 |
|
Fe2+ |
NH3 |
4 |
3,7 |
|
|
CN- |
6 |
36,9 |
|
Fe3+ |
NCS- |
6 |
3,23 |
|
|
CN- |
6 |
43,9 |
|
|
F- |
6 |
16,10 |
|
Hg2+ |
NH3 |
4 |
19,3 |
|
|
CN- |
4 |
41,51 |
|
|
I- |
4 |
29,83 |
|
Mn2+ |
NH3 |
6 |
9 |
|
Ni2+ |
NH3 |
6 |
7,91 |
|
|
CN- |
5 |
30,3 |
|
Pb2+ |
Br- |
4 |
3,00 |
|
|
I- |
4 |
6,20 |
|
Pt2+ |
Cl- |
4 |
16,00 |
|
|
Br- |
4 |
20,05 |
|
|
OH- |
4 |
22,67 |
|
Zn2+ |
OH- |
4 |
14,66 |
|
|
NH3 |
4 |
8,70 |
|
|
CN- |
4 |
19,0 |
.
Таблица 7. Координационное число центрального атома А и пространственная конфигурация комплексов АВn
|
Степень окисл. центр. атома
А |
К.Ч. |
Тип гиб- риди- зации центр. атома |
Пространствен- ная конфигурация комплекса
АВn |
Примеры Соединений |
|
+1 |
2 |
Sp |
Линейная |
[Cu(NH3)2]+,[Ag(CN)2]- |
|
+2 |
4 |
sp3 |
Тетраэдр |
[MnBr4]2-, [CoCl4]2- [Zn(OH)4]2-, [Zn(NH3)4]2+ |
|
+3 |
4 |
sp3 |
Тетраэдр |
[FeCl4]- |
|
+4 |
4 |
sp3 |
Тетраэдр |
[TiO4]4-
|
|
+6 |
4 |
sp3 |
Тетраэдр |
[MnO4]2-,[CrO4]2-, [FeO4]2-,[RuO4]2- |
|
+2 |
6 |
sp3d2 |
|
[MnF6]4-, [Cd(NH3)6]2+,[V(H2O)6]2+, [Fe(CN)6]4-,[Ni(H2O)6]2+, [Co(NH3)6]2+ |
|
+3 |
6 |
sp3d2 |
Октаэдр |
[TiF6]3-,[Ti(H2O)6]3+, [Fe(H2O)6]3+,[Fe(NH3)6]3+, [Co(CN)6]3-,[RhCl6]3-, [IrCl6]3-,[Fe(SCN)6]3- |
|
+4 |
6 |
sp3d2 |
Октаэдр |
[VO(OH2)5]2+,[MnCl6]2-, [CoF6]2-,[Pt(NH3)6]4+, [IrCl6]2- |
|
+6 |
6 |
sp3d2 |
Октаэдр |
[PtF6],[RuF6],[OsO2Cl4]2- |
|
+2 |
4 |
Dsp2 |
Квадрат |
[Pt(NH3)4]2+,[Ni(CN)4]2- |
|
+3 |
4 |
Dsp2 |
Квадрат |
[AuCl4]- |
Таблица 8. Длины волн спектра и соответствующие им окраски
|
Интервалы длин волн погл. света нм |
Цвет поглощаемого излучения |
Наблюдаемый цвет (дополн. цвет)
|
|
400 - 435 |
фиолетовый |
жёлто-зелёный |
|
435 - 480 |
синий |
Жёлтый |
|
480 - 490 |
зеленовато-синий |
Оранжевый |
|
490 - 500 |
сине-зелёный |
Красный |
|
500 - 560 |
зелёный |
Пурпурный |
|
560 - 580 |
жёлто-зелёный |
Фиолетовый |
|
580 - 595 |
Жёлтый |
Синий |
|
595 - 605 |
Оранжевый |
зеленовато-синий |
|
605 - 730 |
Красный |
сине-зелёный |
|
730 - 760 |
Пурпурный |
Зелёный |
Спектрохимический ряд для лигандов комплексных соединений
I < Br < SCN- < Cl <NO3- < F < OH < ONO- < C2O42 < H2O < NCS < CH3CN < NH3 < глицин < пиридин < этилендиамин< дипиридил < о-фенантролин < NC- < NO2 < CN < CO.