
- •ОГЛАВЛЕНИЕ
- •1. РАСЧЕТЫ БЕЗ ХИМИЧЕСКИХ РЕАКЦИЙ
- •1.1. Аддитивные смеси
- •1.2. Определение формулы химического соединения по явно заданным количественным параметрам.
- •2. Расчеты с использованием уравнений химических реакций.
- •2.1. Определение формулы неизвестного вещества по количественным данным о его превращениях.
- •2.2. РАСЧЕТ ПО ОДНОМУ УРАВНЕНИЮ РЕАКЦИИ
- •2.3. Расчеты по нескольким уравнениям химических реакций
- •1. Рассуждения о «ключиках», или почему задачи называются «качественными».
- •2. Виды ключей
- •2.1. Органолептические свойства, идентификация по цвету и запаху, аналитические качественные определения.
- •2.2. Агрегатное состояние.
- •2.3. Ключевое химическое свойство.
- •2.4. Расчет как ключевой фактор в решении качественных задач.
- •2.5. Уникальные физические свойства. Структурные, изотопные или спектральные особенности соединений как ключевой фактор логики решения задачи.
- •2.6. Задачи, требующие эрудиции и/или сообразительности
- •Раздел III. Задачи-эссе. Научные проблемы в виде задач химических олимпиад

И. В. Свитанько, В. В. Кисин, С. С. Чуранов
Стандартные алгоритмы решения
нестандартных химических задач
Учебное пособие для подготовки к олимпиадам школьников по химии
Химический факультет Московского государственного университета им.М.В.Ломоносова Высший химический колледж Российской академии наук
Издательство физико-математической литературы (ФИЗМАТЛИТ)
Москва, 2012

И. В. Свитанько, В. В. Кисин, С. С. Чуранов Стандартные алгоритмы решения нестандартных химических задач.
–М., Химический факультет МГУ им. М. В. Ломоносова;
–М., Высший химический колледж РАН;
–М., Издательство физико-математической литературы (ФИЗМАТЛИТ) 2012. 253c.
ISBN 9875-94052-218-8
Задачи по химии классифицированы по структуре условия и методам их решения – задачи с составлением одной пропорции, стехиометрические схемы, задачи на смеси и др. Приведены обобщенные алгоритмы решения каждого типа задач. Цель пособия – показать, что большинство расчетных задач по химии, в том числе олимпиадных, может быть решено с применением минимального количества стандартных математических операций. Для качественных задач по химии также сделана попытка отследить стандартные формулировки таких задач, а также закономерности алгоритмов их решений.
Рекомендовано ученым советом Высшего химического колледжа РАН и ученым советом кафедры фундаментальных проблем химии химического факультета Московского государственного университета им. М.В.Ломоносова для подготовки к олимпиадам школьников по химии, а также для поступающих в вузы химиче-
ского профиля.
ISBN 9875-94052-218-8
©Составление: И.В.Свитанько, В.В.Кисин, С.С.Чуранов, 2012.
©Оформление и верстка: И.В.Свитанько, 2012.
2
ОГЛАВЛЕНИЕ |
|
Раздел I. Алгоритмы решения расчетных задач |
|
1. Расчеты без химических реакций............................................................. |
6 |
1.1. Аддитивные смеси .................................................................... |
6 |
1.2. Определение формулы химического соединения по явно |
|
заданным количественным параметрам ........................................ |
9 |
2. Расчеты с использованием уравнений химических реакций ............... |
19 |
2.1. Определение формулы вещества по количественным |
|
данным о его превращениях ........................................................... |
19 |
2.2. Расчет по одному уравнению реакции .................................... |
44 |
2.2.1. Простая пропорция с явно заданными количе |
|
ственными параметрами .................................................... |
44 |
2.2.2. Избыток (недостаток) одного из реагентов ............ |
50 |
2.2.3. Неявно заданные количественные параметры ....... |
53 |
2.2.4. Расчеты с использованием разности масс |
|
реагентов и продуктов реакции ....................................... |
61 |
2.2.5. Сравнение количественных данных нескольких |
|
процессов ............................................................................. |
64 |
2.3. Расчеты по нескольким уравнениям химических реакций ... |
70 |
2.3.1. Последовательные реакции (составление |
|
«стехиометрических схем») ............................................... |
70 |
2.3.2. Расчеты по уравнениям одновременно |
|
протекающих реакций («задачи на смеси») ..................... |
79 |
Раздел II. Алгоритмы решения качественных задач |
|
II.1. Задачи-головоломки |
|
1. Рассуждения о ключиках, или почему задачи называются |
|
«качественными» .......................................................................................... |
105 |
2. Виды ключей ............................................................................................. |
107 |
2.1. Органолептические свойства, идентификация по цвету и запаху, |
|
аналитические качественные определения ................................................ |
110 |
2.2. Агрегатное состояние ............................................................................ |
117 |
2.3. Ключевое химическое свойство ........................................................... |
123 |
2.4. Расчет как ключевой фактор в решении качественных задач ............ |
142 |
2.5. Уникальные физические свойства. Структурные, |
|
спектральные особенности соединений как ключевой фактор |
|
логики решения задачи ................................................................................. |
170 |
2.6. Задачи, требующие эрудиции и/или сообразительности .................... |
178 |
II.2 Задачи-эссе (научные проблемы в задачах химических |
|
олимпиад) ...................................................................................................... |
211 |
3
Посвящается другу и учителю Сергею Сергеевичу Чуранову, олицетворявшему эпоху, когда все только начиналось...
Игорь Свитанько, Вадим Кисин
Предисловие
Никого не собираемся убеждать в правильности издания книг для избранных
– либо есть понимание, что будущее страны - в руках у нынешних вундеркиндов (если не уедут), либо нет.
Ни при каких экономических обстоятельствах не переведется тип энтузиастаучителя, отдающего остаток сил (после школьной каждодневной суеты) той малой части учеников, чьи имена могут войти в историю отечественной науки.
Для того, чтобы помочь такому учителю не так часто изобретать велосипед, а его ученику дать возможность что-то делать самостоятельно, не разыскивая старые копии задач минувших олимпиад, а используя приведенные достаточно очевидные алгоритмы и примеры задач, и задуман этот задачник.
Практически все задачи взяты из химических олимпиад разных лет, и большая часть из них - авторские. Остальные сочинялись таким большим количеством наших коллег, что нет никакой возможности изъясниться в уважении всем. Несколько имен, принадлежащих эпохе 60-70-х, откуда в основном взяты задачи, тем не менее, назовем – это В.С.Днепровский, В.В.Загорский, В.И.Дайнеко, В.Г.Розанцев, В.В.Стецик, Т.А.Адамович, Г.Б.Вольеров.
Практика показывает, что задачи олимпиад, не требующие нетрадиционного мышления, быстро оказываются в перечне задач приемных экзаменов какоголибо известного ВУЗа. Это лестно, но реально полезен для развития химической логики другой класс задач - задачи “с изюминкой”, требующие, помимо знания предмета, нестандартного логического подхода. Иногда это “замаскированные” под задачи реальные научные проблемы, а иногда за условием на полстраницы кроется решение на полстроки.
У того читателя (“решателя”), который считает, что никакие химические проблемы ему не страшны, имеется возможность убедиться в этом, прорешав предложенные задачи. Для начала предлагаем поделить квадрат на пять равных по площади частей.
Авторы
4
Введение
Существующие в школьной или факультативной практике алгоритмы решения задач по химии строго говоря, таковыми не являются – они показывают, как и в какой последовательности решать конкретную задачу или узко очерченный тип задач с варьирующимися данными, но не обобщают в один или несколько универсальных алгоритмов все имеющиеся задачи динамического типа. Динамическими мы называем задачи, использующие для расчетов уравнения химических реакций (в отличие от статических, в которых нет химических реакций).
В первой части книги проведена алгоритмизация (по методам решения) следующих типов задач по химии:
–установление формулы вещества по количественным данным о его составе или продуктах превращений;
–использование правила аддитивности:
(c1m1+c2m2+....+ckmk) = c(общ)(m1+m2+....+mk), где c1...ck – «свойства» компо-
нентов смеси, например, концентрация, температура и др., m1...mk – вклады
этих компонентов в смесь; c(общ) – «свойство» смеси; m1+m2...mk |
масса сме- |
|||||
си; |
|
|
|
|
|
|
– |
задачи |
с |
расчетами |
по |
уравнениям последовательных |
реакций |
(«стехиометрическим схемам»); |
|
|
||||
– |
задачи |
с |
расчетами |
по |
уравнениям параллельных |
реакций |
(«на смеси»). |
|
|
|
|
||
Первые два типа относятся к статическим, последние – к динамическим задачам. Такое деление несколько условно, но оно помогает «разложить по полочкам» иногда достаточно сумбурные условия и еще более сумбурные решения химических задач.
Материал первой части иллюстрирован задачами (как стандартными школьными, так и олимпиадными высокого уровня), которые можно решить, используя приведенные алгоритмы. Описываемые алгоритмы могут быть легко реализованы в простейших компьютерных программах.
Во второй части книги задачи сгруппированы по ключикам, намекам на решение. Внутри каждого раздела сначала идут простые задачи, затем более сложные. Решения задач, казавшихся авторам проблемными или наиболее общими, даны подробно, остальных – схематично (решение фактически представляет собой расширенный ответ). Авторы попытались обобщить принципы, которые используются при составлении «качественных» задач (в которых совсем не обязательно отсутствуют расчеты – но если расчеты в них есть, то они не играют ключевой роли), а также методы их решения.
5
Раздел I.
Алгоритмы решения расчетных задач
1.РАСЧЕТЫ БЕЗ ХИМИЧЕСКИХ РЕАКЦИЙ
1.1.Аддитивные смеси
Аддитивными смесями назовем смеси, подчиняющиеся общему закону аддитивности:
C1M1+C2M2+...+CnMn = Cсм(M1+ M2 +...+ Mn) |
(1) |
где C1...Cn – «свойства» компонентов смеси, например, теплоемкость, температура, массовые доли вещества в растворе и другие;
M1...Mn – «массы» компонентов; Ссм – «свойство» смеси.
Аддитивность результирующего свойства cмеси определяется тем, что компоненты не взаимодействуют друг с другом, давая линейную суперпозицию свойств.
По такому пропорциональному соотношению (1) легко рассчитать любой неизвестный параметр смеси по известным остальным.
«Расщепим» задачу на две – нахождение параметров смеси по параметрам компонентов и определение параметров компонента по известным данным. Обозначим за i количество компонентов. Тогда
CCM = |
RCi Mi |
, a Cx = |
MCM CCM - RMi Ci |
|
Mx |
||
|
MCM |
||
где Cсм– свойство смеси, x – компонент с неизвестным параметром,
а Mx=M0 – SMi-1.
sСоставим алгоритмы более сложных случаев:
1)Смесь из двух компонентов с двумя неизвестными параметрами.
2)Смесь произвольного количества компонентов с одним неизвестным параметром (не считая одной из масс компонентов или массы смеси, которая легко вычисляется по разности или сумме).
Первый случай – пропорции для аддитивных смесей их двух компонентов с двумя неизвестными.
Для двухкомпонентной смеси соотношение (1) имеет вид
C1m1 + C2m2 = C0(m1 + m2) |
(2) |
Преобразовываем в отношение m1/m2:
6
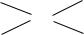
C1m1 – C0m1 = C0m2 – C2m2 |
|
||
m1(C1 – C0) = m2(C0 – C2); |
|
||
m1 |
C0 |
– C2 |
(3) |
m2 |
= C1 |
– C0 |
|
Представив эту пропорцию в виде «креста»:
1 |
|
C0 – C2 |
m1 |
C |
C0 |
C1 – C0 |
= m2 |
2 |
|||
C |
|
|
|
получим так называемое «правило креста». Разберем несколько примеров.
Пример 1. Чему равно содержание (%) изотопов неона 20Ne и 22Ne в природном неоне, имеющем, в соответствии с Периодической системой элементов, относительную атомную массу 20,2?
Решение. Примем за x число атомов 20Ne в каждых 100 атомах природного неона, тогда число атомов 22Ne будет (100–x). Масса x атомов 20Ne равна 20x, а масса (100–x).атомов равна 22Ne – 22 .(100–x). По закону аддитивности:
20x + 22 .(100–x) = 20,2 .100
Решение полученного уравнения дает x = 90 (атомов 20Ne) и 100 – 90 = 10 (атомов 22Ne). Таким образом, содержание 20Ne составляет 90%, а содержание
22Ne – 10%.
Пример 2. Каково содержание изотопов 35Cl и 37Cl в природном хлоре, имеющем относительную молекулярную массу 70,90? Предложите способы выделения чистых веществ 35Cl2 и 37Cl2 из природного хлора и его соединений.
Решение. Примем за x содержание 35Cl в природной смеси изотопов: 35 . x + 37·(100 – x) = 35,45 .100
x = 77,5.
Ответ: 77,5% 35Cl и 22,5% 37Cl.
Способы разделения изотопов:
–основанные на различии в массе (центрифугирование и т.п.);
–основанные на различном отношении массы к заряду (для ионов);
–основанные на изотопном эффекте в химических процессах (кинетические).
Пример 3. а) Каковы массы 10- и 25%-ных растворов гидроксида натрия, которые необходимо смешать для получения 200 г 20%-ного раствора?
б) Каковы массы 30%-ного раствора серной кислоты и воды, необходимые для получения 300 г 10%-ного раствора?
Решение. Воспользуемся только что выведенным «правилом креста»:
7

a) |
10 |
20 |
|
5 |
= m1 |
, т.е. |
m1 |
= |
1 |
|
25 |
10 |
m2 |
2 |
|||||||
|
|
m2 |
|
|
||||||
Такимобразом,дляприготовления200 г20%-ногораствораNaOH надо взять
1·200/3 = 66,66 г 10%-ного раствора и 2·200/3 = 133,33 г 25%-ного раствора NaOH.
б) Аналогично, 300  10
10  1020 = 12 , и массы 10%-ной H2SO4 и
1020 = 12 , и массы 10%-ной H2SO4 и
воды – 1·300/3=100 г 30% H2SO4
2·300/3=200 г воды.
Пример4. а) Сколько миллилитров воды следует взять для растворения 27,8 г FeSO4·7H2O, чтобы приготовить 8%-ный (по массе) раствор FeSO4?
б) Сколько граммов FeSO4·7H2O нужно добавить к этому раствору, чтобы массовая доля возросла до 15%?
Решения:
Вариант а1) В 1 моль FeSO4·7H2O содержится 1 моль FeSO4. Для приготовления раствора взяли 27,8 или 27,8/278 = 0,1 моль кристаллогидрата. Следовательно, в полученном растворе содержится 0,1 моль, или 152·0,1 = 15,2 г FeSO4.
Прибавили x г воды, получили массовую долю FeSO4 в растворе:
w1(FeSO4)(%) = |
15,2 |
·100% = 8%; |
x = 162,2 г. |
|
(27,8+x) |
||||
|
|
|
Вариант а2) Рассматриваем FeSO4·7H2O как «квазираствор» FeSO4 в собственной кристаллизационной воде. Тогда массовая доля FeSO4 в этом «рас-
творе» – 152/278 = 0,547.
Теперь мы можем применить правило креста для «растворов» с содержанием
FeSO4 152/278 и 0:
0,547 |
0,080 |
0,08 |
Отсюда x = 162,3 г |
|
0 |
0,467 |
|||
|
|
Вариантб1)Есливполученныйрастворвнестиyг,т.е.y/278мольFeSO4·7H2O, то масса раствора станет равной (27,8 + 162 + y) г, а масса растворенного FeSO4 в этом растворе будет равна:
15,2+0,574y w2(FeSO4)(%) = 27,8+162,2+y ·100% = 15%
Отсюда y = 33,5 г.
Вариант б2) Применим правило креста для реального 8%-ного раствора и
8
