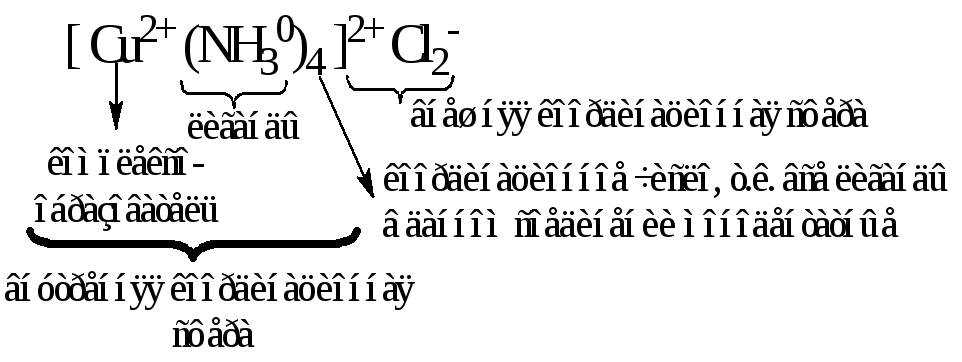- •Применение закона действующих масс к растворам электролитов Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Гетерогенные равновесия Константа растворимости. Правило растворимости осадков
- •1. Если стехиометрическое произведение молярных концентраций ионов труднорастворимого электролита в растворе равно величине егоKs (или пр) при данной температуре
- •2. Если стехиометрическое произведение молярных концентраций ионов в растворе электролита меньше величины его ks
- •3. В перенасыщенном растворе стехиометрическое произведение молярных концентраций труднорастворимого электролита больше величины его ks
- •Образование и растворение осадков
- •Однотипные и разнотипные конкурирующие равновесия в гетерогенных системах
- •Определение комплексных соединений и их общая характеристика
- •Строение комплексных соединений
- •Классификация комплексных соединений
- •Диссоциация комплексных соединений
- •Гидролиз солей
- •3. Соли, образованные сильной кислотой, но слабым основанием:
- •Количественный анализ основы титриметрического метода анализа Химический эквивалент
- •Молярная масса эквивалентов вещества
- •Химическое количество эквивалентов вещества
- •Молярная концентрация эквивалентов вещества
- •Закон эквивалентов
- •Титриметрический анализ Общая характеристика метода
- •Требования, предъявляемые к реакциям, которые используют в титриметрии
- •Способы титрования
- •Способы приготовления рабочих растворов
- •Правила работы с мерной посудой при проведении аналитических измерений
- •Мерные колбы
- •Пипетки
- •Бюретки
- •Проведение титрования
- •Кислотно-основное титрование Общая характеристика метода
- •Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
- •Подбор индикаторов при кислотно-основном титровании
- •Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
- •Применение кислотно-основного титрования
- •Редоксиметрия Общая характеристика и классификация методов
- •Кривые титрования в редоксиметрии
- •Способы определения точки эквивалентности
- •Перманганатометрия
- •Иодометрия
- •Физико-химические методы анализа Практическое применение электропроводности
- •Потенциометрия
- •Хроматография Общая характеристика метода
- •Классификация хроматографических методов анализа
- •Методика разделения и идентификации компонентов смеси
- •Содержание
Строение комплексных соединений
Центральное место любого комплексного соединения занимает комплексообразователь (М), называемый иначе центральным атомом (или ядром) комплекса. В его роли чаще всего выступают положительно заряженные ионы металлов (Fe3+,Fe2+,Cr3+,Ag+,Co3+,Zn2+,Cu2+и др.) или их электронейтральные атомы (Fe,Zn,Coи др.). В некоторых случаях комплексообразователем может быть и атом неметалла, находящийся (чаще всего) в своей высшей степени окисленности (Si+4,P+5,S+6), и даже простой анион, образованный атомом неметалла (I–,Br–).
В принципе, в качестве комплексообразователя могут выступать атомы любого элемента (начиная с третьего периода), находящиеся как в нулевой, так и в положительной либо отрицательной степени окисления. Но наиболее ярко эта способность выражена у переходных металлов, т.е. у d- иf-элементов.
Характерной и обязательной особенностью комплексообразователя является наличие у него на внешнем слое определенного числа вакантных электронных орбиталей, за счет которых он может выступать в роли акцептора электронной пары.
Комплексообразователь координирует (собирает) вокруг себя определенное число лигандов(от лат.liganda – то, что должно быть связано) или, по-другому,аддендов(от лат.addenda – то, что должно быть добавлено).
В роли лигандов (L) могут выступать как отрицательно заряженные ионы (анионы), так и электронейтральные молекулы, содержащие в своем составе один или несколько атомов, у которых на внешнем электронном слое имеются неподеленные электронные пары. За счет их лиганд может быть донором электронной пары.
Благодаря своему строению, лиганд способен образовывать с комплексообразователем химическую связь по донорно-акцепторному механизму. В комплексных соединениях такая связь называется иначе координационной.
Наличие хотя бы одной или нескольких координационных связей является характерной особенностью комплексов.
Количество химических связей, которые один лиганд образует (или может образовать) с комплексообразователем (либо число атомов, выделяемых лигандом для их образования), называется иначе дентатностью лиганда (от лат. dentalus – имеющий зубы).
Лиганды, образующие с комплексообразователем только одну связь, называются монодентатными, например:OH–,CN–,Cl–,H2O,NH3,CO. Существуют лиганды, способные образовывать с комплексообразователем 2 и более связи. Такие лиганды называются, соответственно,би-(илиди-) иполидентатными.
Примерами бидентатных лигандов могут служить оксалат-ион C2O42–, карбонат-ионCO32–, сульфат-ионSO42–, молекула этилендиамина:
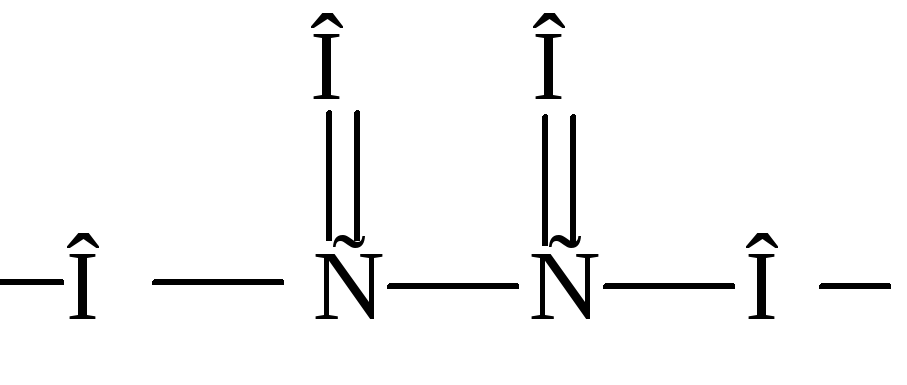
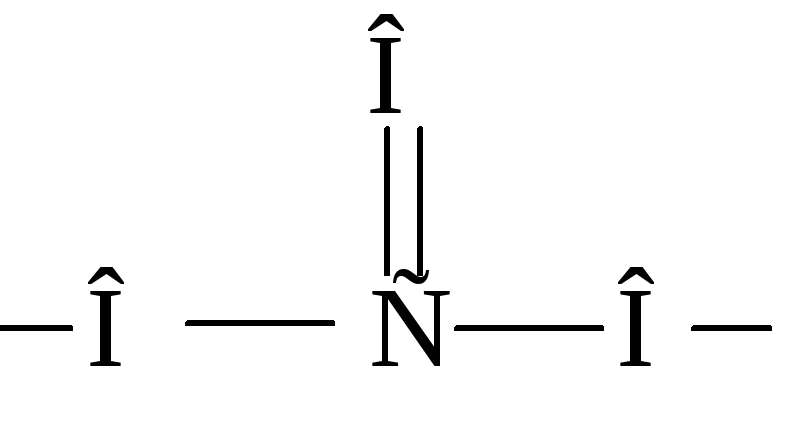
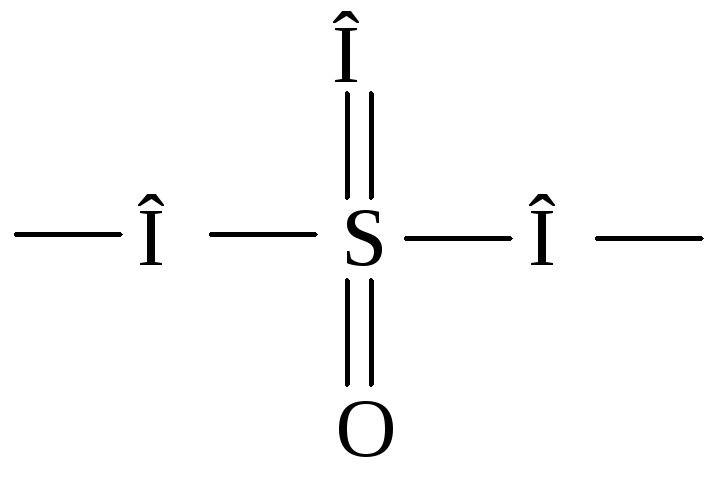
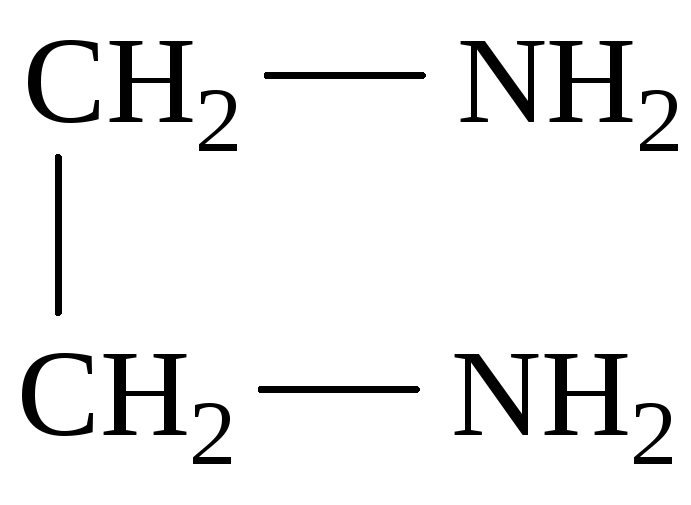
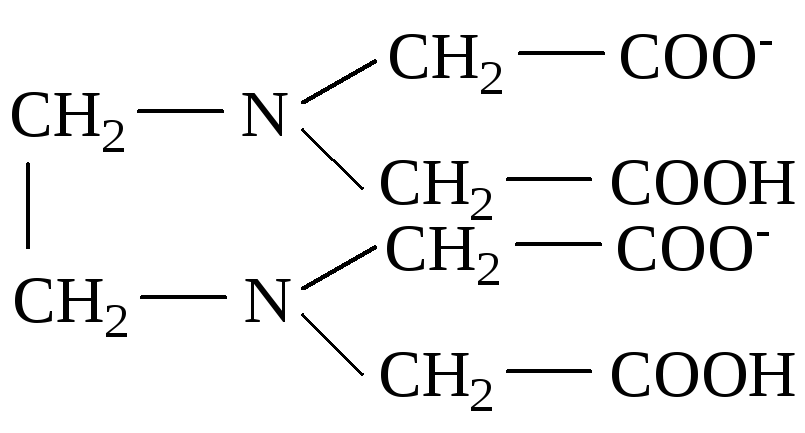
Четырехдентатным лигандом является двухзарядный ион этилендиаминтетрауксусной кислоты (ЭДТА):
Би- и полидентатные лиганды в зависимости от обстоятельств могут вести себя и как монодентатные, т.е. образовывать с комплексообразователем только одну связь.
Общее число связей, которые лиганды образуют с комплексообразователем (или общее число выделяемых ими для этих целей атомов) называется иначе координационным числом.
С монодентатными лигандами оно равно числу лигандов в комплексе, в случае полидентатных лигандов – произведению числа таких лигандов на их дентатность.
Значения координационных чисел в комплексных соединениях варьируют в пределах от 1 до 12, но наиболее часто встречающиеся – 4 и 6.
На основании анализа координационных чисел большого количества комплексных соединений еще А. Вернер пришел к выводу, что основным фактором, влияющим на их величину, является значение заряда (или степени окисления) центрального иона. Ниже сопоставлены наиболее характерные координационные числа и заряд комплексообразователя:
|
Степень окисления комплексообразователя |
+1 |
+2 |
+3 |
+4 |
|
Координационное число |
2 |
4, 6 |
6, 4 |
8 |
Жирным числом выделены чаще встречающиеся координационные числа в тех случаях, когда возможны 2 различных типа координации.
Приведенные координационные числа соответствуют максимальному насыщению координационной сферы и относятся к координационно-насыщенным соединениям.
Но в растворах не всегда соблюдаются условия для получения таких веществ, и тогда образуются координационно-ненасыщенные комплексы с меньшими координационными числами.
Координационное число не является неизменной и постоянной величиной для данного комплексообразователя, а обусловлено также природой лигандов, их электронными свойствами. Даже для одних и тех же комплексообразователя и лигандов существуют комплексные соединения с разным координационном числом.
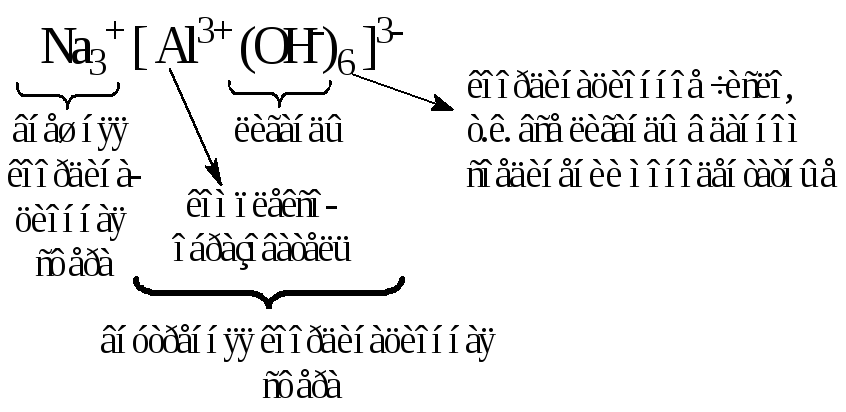
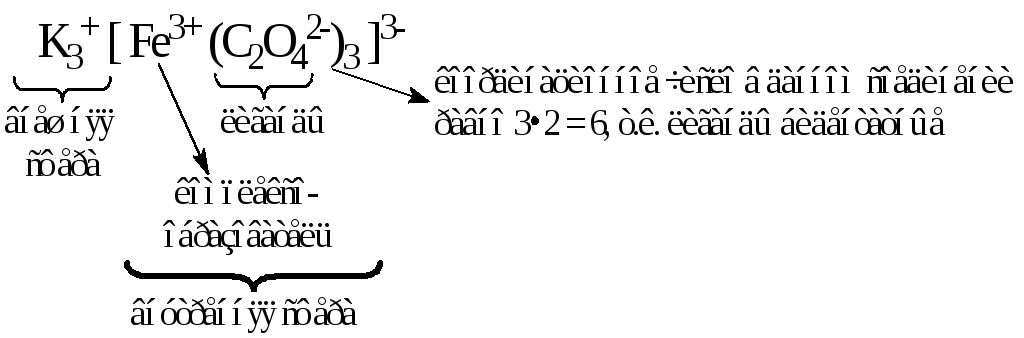
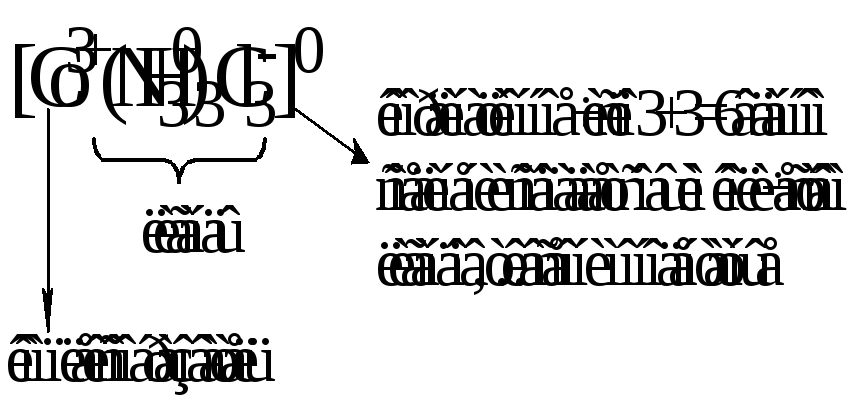
Комплексообразователь вместе с удерживаемыми им лигандами образует так называемуюкомплексную частицуиливнутреннюю координационную сферу. При написании химических формул комплексных соединений внутренняя сфера берется в квадратные скобки. Вначале записывают центральный атом М, а затем – лигандыL, с указанием их числаn. При этом лиганды в зависимости от заряда располагаются в следующем порядке. Первыми записываются лиганды, имеющие положительный заряд, затем – электронейтральные и, наконец – лиганды с отрицательным зарядом:
[M(L+)(L0)(L–)]
Заряд комплексной частицы (внутренней сферы) равен алгебраической сумме зарядов составляющих его комплексообразователя и лигандов (если в роли лиганда выступает молекула, то ее заряд принимается равным нулю), например:
Cu+ + 2CN– [Cu(CN)2]– (+1 – 2 = –1)
Al3+ + 6OH– [Al(OH)6]3– (+3 – 6 = –3)
Cu2++ 4NH30[Cu(NH3)4]2+(+2 + 0 = +2)
Внутренняя сфера, имеющая электрический заряд, называется иначе комплексным ионом.
Внутренняя координационная сфера (или комплексный ион) в значительной степени сохраняет свою целостность при растворении комплекса.
Если суммарный заряд внутренней сферы не равен нулю, то в таком комплексном соединении присутствует еще и внешняя координационная сфера. В ее состав всегда входят ионы, знак заряда которых противоположен знаку заряда внутренней сферы.
Значение суммарного заряда всех ионов внешней сферы по абсолютной величине совпадает с зарядом комплексного иона, но отличается знаком. Таким образом, в целом молекула комплексного соединения остается электронейтральной.
Ионы внешней сферы непосредственно с комплексообразователем не образуют связей и удерживаются вокруг комплексного иона только за счет действия электростатических сил. В водных растворах они легко отщепляются от внутренней сферы в результате протекания процесса диссоциации.
Если суммарный заряд внутренней сферы равен нулю, то внешняя сфера в таком комплексном соединении отсутствует. При написании его химической формулы квадратные скобки могут не использоваться.
Формулы комплексных соединений составляют по тому же принципу, что и формулы солей, т.е. первой записывают ту часть их молекул (ту координационную сферу), которая несет положительный заряд. Рассмотрим примеры написания формул комплексных соединений и обозначим их составные части: