
38.Спиртовое брожение осуществляется так называемыми дрожжеподобными организмами, а также некоторыми плесневыми грибками. Суммарную реакцию спиртового брожения можно изобразить следующим образом:
![]()
![]()
Механизм реакции спиртового брожения чрезвычайно близок к гликолизу. Расхождение начинается лишь после этапа образования пирувата. При гликолизе пируват при участии фермента ЛДГ и кофермента НАДН восстанавливается в лактат. При спиртовом броженииэтот конечный этап заменен двумя другими ферментативными реакциями – пируватдекарбо-ксилазной и алкогольдегидрогеназной.
В дрожжевых клетках (спиртовое брожение) пируват вначале подвергается декарбоксилированию, в результате чего образуетсяацетальдегид. Данная реакция катализируется ферментом пируватдекарбоксилазой, который требует наличия ионов Mg и кофермента(ТПФ):
![]()
![]()
Образовавшийся ацетальдегид присоединяет к себе водород, отщепляемый от НАДН, восстанавливаясь при этом в этанол. Реакциякатализируется ферментом алкогольдегидрогеназой:
![]()
![]()
Таким образом, конечными продуктами спиртового брожения являются этанол и СО2, а не молочная кислота, как при гликолизе.
39. Катаболизм этилового спирта осуществляется главным образом в печени. Здесь окисляется от 75% до 98% введённого в организм этанола.
Окисление алкоголя - сложный биохимический процесс, в который вовлекаются основные метаболические процессы клетки. Превращение этанола в печени осуществляется тремя путями с образованием токсического метаболита – ацетальдегида.
Основную роль в метаболизме этанола играет цинксодержащий NAD+- зависимый фермент - алкогольдегидрогеназа, локализующаяся в основном в цитозоле и митохондриях печени (95%). В ходе реакции происходит дегидрирование этанола, образуются ацетальдегид и восстановленный кофермент NADH.
Фермент алкогольдегидрогеназа - димер, состоящий из идентичных или близких по первичной структуре полипептидных цепей, кодируемых аллелями одного гена. Существуют 3 изоформы алкогольдегидрогеназы (АДГ): АДГ1, АДГ2, АДГ3, различающиеся по строению протомеров, локализации и активности. Для европейцев характерно присутствие изоформ АДГ1 и АДГ3. У некоторых восточных народов преобладает изоформа АДГ2, характеризующаяся высокой активностью, это может быть причиной их повышенной чувствительности к алкоголю. При хроническом алкоголизме количество фермента в печени не увеличивается, т.е. он не является индуцируемым ферментом.
Цитохром Р450-зависимая микросомальная этанолокисляющая сисгема (МЭОС) локализована в мембране гладкого ЭР гепатоцитов. МЭОС играет незначительную роль в метаболизме небольших количеств алкоголя, но индуцируется этанолом, другими спиртами, лекарствами типа барбитуратов и приобретает существенное значение при злоупотреблении этими веществами.
С2Н5ОН + NADPH + Н+ + О2 → СН3СНО + NADP+ + 2Н2О.
Второстепенную роль в окислении этанола играет каталаза, находящаяся в пероксисомах цитоплазмы и митохондрий клеток печени. Этот фермент расщепляет примерно 2% этанола, но при этом утилизирует пероксид водорода.СН3СН2ОН + Н2О2 → СН3СНО + 2Н2О.
Ацетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты двумя ферментами: FAD -зависимой альдегидоксидазой и NAD+ -зависимой ацетальдегиддегидрогеназой (АлДГ).
СН3СНО + О2 + H2O → СН3СООН + Н2О2 .
Другой фермент ацетальдегиддегидрогеназа (АлДГ) окисляет субстрат при участии кофермента NAD+.
СН3СНО + Н2О + NAD+ → СН3СООН + NADH + H+.
Ферменты, участвующие в окислении этанола, - алкогольдегидрогеназа и АлДГ по разному распределены: в цитозоле - 80%/20% и митохондриях - 20%/80%. При поступлении больших доз алкоголя (более 2 г/кг) из-за разных скоростей окисления этанола и ацетальдегида в цитозоле резко повышается концентрация последнего. Ацетальдегид - очень реакционно-способное соединение; он неферментативно может ацетилировать SH-, NH2- группа белков и других соединений в клетке и нарушать их функции. Активное окисление этанола и ацетальдегида приводит к увеличению отношения NADH/NAD+, что снижает активность NAD+-зависимых ферментов в цитозоле и менее значительно в митохондриях.
На начальных стадиях алкоголизма окисление ацетил-КоА в ЦТК - основной источник энергии для клетки. Избыток ацетил-КоА в составе цитрата выходит из митохондрий, и в цитоплазме начинается синтез жирных кислот. Этот процесс, помимо АТФ, требует участия NADPH, который образуется при окислении глюкозы в пентозофосфатном цикле. Из жирных кислот и глицерол-3-фосфата образуются ТАГ, которые в составе ЛПОНП секретируются в кровь. Повышенная продукция ЛПОНП печенью приводит к гипертриацилглицеролемии. При хроническом алкоголизме снижение синтеза фосфолипидов и белков в печени, в том числе и апобелков, участвующих в формировании ПОНП, вызывает внутриклеточное накопление ТАГ и ожирение печени.
Однако в период острой алкогольной интоксикации, несмотря на наличие большого количества ацетил-КоА, недостаток оксалоацетата снижает скорость образования цитрата. В этих условиях избыток ацетил-КоА идёт на синтез кетоновых тел, которые выходят в кровь. Повышение в крови концентрации лактата, ацетоуксусной кислоты и β-гидроксибутирата служит причиной метаболического ацидоза при алкогольной интоксикации.
40. Аэробным гликолизом называют процесс окисления глюкозы до пировиноградной кислоты, протекающий в присутствии кислорода. Все ферменты, катализирующие реакции этого процесса, локализованы в цитозоле клетки.
Протекает он в 3 этапа: 1) гликолиз с образованием пировиноградной кислоты; 2) окислительное декарбоксилирование пировиноградной кислоты до (ацетил-КоА); 3) окисление последнего в цикле Кребса до углекислого газа и воды. Энергетический баланс аэробного окисления глюкозы значительно выше, чем анаэробного, и составляет 38 молекул АТФ.
Реакции аэробного гликолиза Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата
Превращение глицеральдегид-3-фосфата в пируват. Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ.
Окисление цитоплазматического NADH в митохондриалъной дыхательной цепи.NADH, образующийся при окислении глицеральдегид-3-фосфата в аэробном гликолизе, подвергается окислению путём переноса атомов водорода в митохондриальную дыхательную цепь. Однако цитозольный NADH не способен передавать водород на дыхательную цепь, потому что митоховдриальная мембрана для него непроницаема. Перенос водорода через мембрану происходит с помощью специальных систем, называемых "челночными". В этих системах водород транспортируется через мембрану при участии пар субстратов
Выход АТФ при аэробном гликолизе На образование фруктозо-1,6-бисфосфата из одной молекулы глюкозы требуется 2 молекулы АТФ. Реакции, связанные с синтезом АТФ, происходят после распада глюкозы на 2 молекулы фосфотриозы, т.е. на втором этапе гликолиза. На этом этапе происходят 2 реакции субстратного фосфорилирования и синтезируются 2 молекулы АТФ.
41. Глюконеогенез — синтез глюкозы из соединений неуглеводной природы. В организме взрослого человека за сутки может синтезироваться до 250 г глюкозы. Глюконеогенез осуществляется главным образом в печени (синтезируетя до 90 % всей глюкозы), в корковом веществе почек и в энтероцитах (совсем незначительно). Глюконеогенез стимулируется при длительном голодании, при ограничении поступления углеводов с пищей, в период восстановления после мышечной нагрузки, у новорождённых в первые часы после рождения
2ПВК + 4АТФ + 2ГТФ + 2НАДН Н+ + 2Н+ + 6Н2О → Глюкоза + 4АДФ + 2ГДФ + 6Фн + 2НАД+
Глюконеогенез протекает, в основном, по тому же пути, что и гликолиз, но в обратном направлении.
Энергетический баланс.На синтез молекулы глюкозы из двух молекул пирувата расходуется 4АТФ и 2ГТФ (6АТФ). Энергию для глюконеогенеза поставляет процесс β-окисления жирных кислот.
Биологическая роль глюконеогенеза:
1. Поддержание уровня глюкозы в крови. При длительном голодании (голодание более суток) глюконеогенез является единственным процессом, поставляющим глюкозу в кровь.
2. Возвращение лактата в метаболический фонд углеводов. Лактат, образующийся в процессе анаэробного окисления глюкозы в эритроцитах и скелетных мышцах, транспортируется кровью в печень и превращается в гепатоцитах в глюкозу. Это так называемый межорганный цикл Кори.
4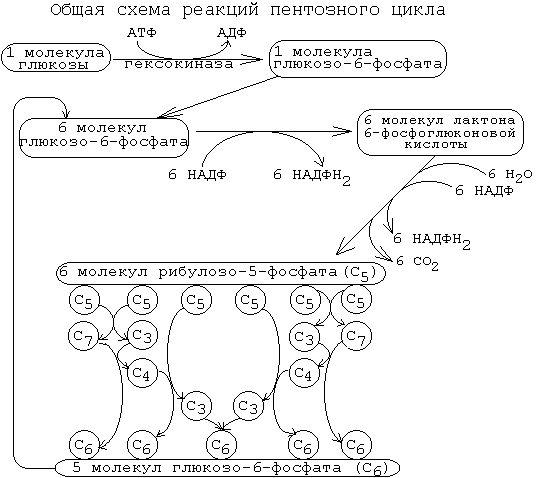 2.
2.
Пентозофосфатный цикл активно функционирует в печени, жировой ткани, коре надпочечников, семенниках и в молочной железе в период лактации. В этих тканях активно идут процессы синтеза высших жирных кислот, аминокислот или стероидов, нуждающиеся в восстановительных эквивалентах в виде НАДФН+Н+.Цикл интенсивно работает также в эритроцитах, в которых НАДФН+Н+используется для подавления перекисного окисления мембранных липидов. Мышечная ткань содержит очень малые количества глюкозо-6-фосфатдегидрогеназы и 6-фосфоглюконатдегидрогеназы, тем не менее, она также способна синтезировать необходимую клеткам рибозу.
43. Гипергликемия- высокое содержание сахара в крови. Уровень сахара в норме регулирует гормон инсулин. При сахарном диабете инсулин не вырабатывается в должном количестве. А значит, поддержание уровня сахара в крови в пределах нормы является основной задачей лечения. Гипергликемию у диабетиков может вызвать чрезмерное и неправильное питание, недостаточная физическая нагрузка, пропуск очередного введения инсулина или приема сахароснижающих препаратов, стресс, инфекционные заболевания и даже менструации. Проявление: усиление жажды, частое мочеиспускание, усталость и утомляемость, повышение аппетита, помутнение зрения и появление мурашек перед глазами, головная боль, снижение концентрации внимания, сухость кожи, раздражительность.
Гипогликемия –низкий уровень сахара в крови. Это состояние возникает только у больных, получающих сахароснижающие препараты (инсулин или сахароснижающие таблетки), и является осложнением не заболевания, а лечения. Причины снижения сахара в крови могут быть самые разные: пропуск приема пищи, чрезмерная физическая нагрузка, прием алкоголя, стрессовая ситуация и т.д. Проявление: спутанность сознания, дрожь, потливость, озноб, помутнение зрения, головная боль, слабость, затруднение речи, онемение губ.
Нормогликемия-нормальное содержание уровня глюкозы в крови. Гипогликемия-понижение концентрации глюкозы в крови. Гипергликемия- повышенное содержание концентрации глюкозы в крови.Гипергликемия может возникнуть при заболеваниях поджелудочной железы,в результате расстройства функции других эндокринных желез,участвующих в регуляции углеводного обмена.Поддержание постоянства уровня глюкозы в крови- это важнейшая функция печени, поэтому гипергликемия, обусловленная нарушением фунункции печени,выявляется при тяжелых ее поражениях.В клинике для изучения реактивности организма используют сахарную нагрузку.
Гипогликемия связана с понижением тех эндокинных желез,повышение функций которых приводит к гипергликемии..Также может возникнуть при введении больным сахарным диабетом больших доз инсулина, при этом гипогликемия сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы.
При нормальном уровне глюкозы в крови почки полностью её реабсорбируют и сахар в моче не определяется. Однако если гликемия превышает 9-10 ммоль/л (почечный порог), то появляетсяглюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии. В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6-8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета.
44. Уровень глюкозы в крови является одним из гомеостатических параметров. Регуляция уровня глюкозы в крови – это сложный комплекс механизмов, обеспечивающий постоянство энергетического гомеостаза для наиболее жизненно важных органов (мозг, эритроциты). Глюкоза – главный и едва не единственный субстрат энергетического обмена. Существует два механизма регуляции:
1. Срочный (через ЦНС)
2. Постоянный (через гормональное влияние).
Срочный механизм срабатывает практически всегда при действии на организм любых экстремальных факторов. Он осуществляется по классической модели (через зрительный анализатор воспринимается информация об опасности. Возбуждение из одного очага в коре распространяется по всем зонам коры. Затем возбуждение передаётся на гипоталамус, где находится центр симпатической нервной системы. По спинному мозгу импульсы поступают в симпатический ствол и по постганглионарным волокнам к коре надпочечников. При этом происходит выброс адреналина, который запускает аденилатциклазный механизм мобилизации гликогена).
Срочный механизм поддерживает стабильную гликемию на протяжении 24 часов. В дальнейшем запас гликогена уменьшается и уже спустя 15 – 16 часов подключается постоянный механизм.
Уровень глюкозы в крови является одним из гомеостатических параметров. Регуляция уровня глюкозы в крови – это сложный комплекс механизмов, обеспечивающий постоянство энергетического гомеостаза для наиболее жизненно важных органов (мозг, эритроциты). Глюкоза – главный и едва не единственный субстрат энергетического обмена.
Постоянный (через гормональное влияние): в основе которого лежит глюконеогенез. После истощения запасов гликогена, возбуждённая кора продолжает посылать импульсы в гипоталамус. Отсюда выделяются либерины, которые с током крови заносятся переднюю долю гипофиза, которая, в свою очередь, синтезирует в кровоток СТГ, АКТГ, ТТГ, которые в свою очередь стимулируют выброс трийодтиронина и тиреотропина. Эти гормоны стимулируют липолиз. Тиреотропные гормоны активируют протеолиз, в результате чего образуются свободные аминокислоты, которые как и продукты липолиза используются как субстраты глюконеогенеза и цикла трикарбоновых кислот.
В ответ на повышение уровня глюкозы в крови, происходит выброс инсулина, однако вследствие того, что жирные кислоты и выделяемые гормоны выключают гликолиз в мышечной ткани, потребление глюкозы мышцами не происходит, вся глюкоза сохраняется для мозга и эритроцитов.
В условиях длительного воздействия отрицательных факторов на организм (постоянный стресс) может возникнуть дефицит инсулина, что является одной из причин сахарного диабета.
Инсули́н -гормон пептидной природы, образуется в бета-клетках островков Лангергансаподжелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом.
Нарушение секреции инсулина вследствие деструкции бета-клеток— абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа.
Механизм действия:Осуществление действия инсулина происходит через белок-рецептор, представляющий собой интегральный белок мембраны клетки, который состоит из 2-х субъединиц(a и b), образованных 2-мя полипептидными цепочками.
А-субъединица рецептора распознаёт и связывается с инсулином, изменяя при его присоединении свою геометрическую форму. Вследствие чего проявляется тирозинкиназная активность и у В-субъединицы, что запускает цепь реакций по активации ферментов, которая начинается с самофосфорилирования рецептора
Уровень глюкозы в крови является одним из гомеостатических параметров. Регуляция уровня глюкозы в крови – это сложный комплекс механизмов, обеспечивающий постоянство энергетического гомеостаза для наиболее жизненно важных органов (мозг, эритроциты). Глюкоза – главный и едва не единственный субстрат энергетического обмена. Существует два механизма регуляции:
Срочный (через ЦНС)
Постоянный (через гормональное влияние)
Срочный механизм срабатывает практически всегда при действии на организм любых экстремальных факторов. Он осуществляется по классической модели (через зрительный анализатор воспринимается информация об опасности. Возбуждение из одного очага в коре распространяется по всем зонам коры. Затем возбуждение передаётся на гипоталамус, где находится центр симпатической нервной системы. По спинному мозгу импульсы поступают в симпатический ствол и по постганглионарным волокнам к коре надпочечников. При этом происходит выброс адреналина, который запускает аденилатциклазный механизм мобилизации гликогена).
Срочный механизм поддерживает стабильную гликемию на протяжении 24 часов. В дальнейшем запас гликогена уменьшается и уже спустя 15 – 16 часов подключается постоянный механизм, в основе которого лежит глюконеогенез. После истощения запасов гликогена, возбуждённая кора продолжает посылать импульсы в гипоталамус. Отсюда выделяются либерины, которые с током крови заносятся переднюю долю гипофиза, которая, в свою очередь, синтезирует в кровоток СТГ, АКТГ, ТТГ, которые в свою очередь стимулируют выброс трийодтиронина и тиреотропина. Эти гормоны стимулируют липолиз. Тиреотропные гормоны активируют протеолиз, в результате чего образуются свободные аминокислоты, которые как и продукты липолиза используются как субстраты глюконеогенеза и цикла трикарбоновых кислот.
В ответ на повышение уровня глюкозы в крови, происходит выброс инсулина, однако вследствие того, что жирные кислоты и выделяемые гормоны выключают гликолиз в мышечной ткани, потребление глюкозы мышцами не происходит, вся глюкоза сохраняется для мозга и эритроцитов. В условиях длительного воздействия отрицательных факторов на организм (постоянный стресс) может возникнуть дефицит инсулина, что является одной из причин сахарного диабета.
Постоянный (через гормональное влияние): в основе которого лежит глюконеогенез. После истощения запасов гликогена, возбуждённая кора продолжает посылать импульсы в гипоталамус. Отсюда выделяются либерины, которые с током крови заносятся переднюю долю гипофиза, которая, в свою очередь, синтезирует в кровоток СТГ, АКТГ, ТТГ, которые в свою очередь стимулируют выброс трийодтиронина и тиреотропина. Эти гормоны стимулируют липолиз. Тиреотропные гормоны активируют протеолиз, в результате чего образуются свободные аминокислоты, которые как и продукты липолиза используются как субстраты глюконеогенеза и цикла трикарбоновых кислот.
В ответ на повышение уровня глюкозы в крови, происходит выброс инсулина, однако вследствие того, что жирные кислоты и выделяемые гормоны выключают гликолиз в мышечной ткани, потребление глюкозы мышцами не происходит, вся глюкоза сохраняется для мозга и эритроцитов. В условиях длительного воздействия отрицательных факторов на организм (постоянный стресс) может возникнуть дефицит инсулина, что является одной из причин сахарного диабета.
45. Диабет - это выделение глюкозы с мочой. диабет первого типа (диабет молодых людей, он является инсулиндефицитным).Диабет первого типавозникает в результате абсолютного или относительного дефицита инсулина. Абсолютный дефицит может быть вызван повреждением поджелудочной железы или разрушениемв– клеток или островков Лангерганса, что возникает при опухолях, кистозах, травмах, хирургических вмешательствах. Относительный дефицит возникает при несоответствии между инсулиновой продукцией и его потреблением, то есть инсулин выделяется в недостаточном количестве.Причины:генетические дефекты молекулы инсулина, структуры белков – рецепторов, блокировки инсулина, относительного дефицита инсулина.
Механизм: Срочный механизм осуществляется на первых этапах: происходит гиперполяризация мембраны, стимулируется работа Nа – К – АТФазы и создаётся потенциал, необходимый для транспорта субстратов для пластических и энергетических нужд.
При дефиците инсулина все пути метаболизма глюкозы блокируются, так как возникает недостаточность глюкозы – 6 – фосфат. Дефицит инсулина снижает метаболизм глюкозы и аминокислот в тканях, это снимает инсулиновый тормоз с катаболических реакций: активизируется липолиз, протеолиз, гликогенолиз. Из – за дефицита глюкоза – 6 – фосфата в мышечной ткани нарушается производство АТФ и ткань находится в состоянии энергетического голода. Это состояние расценивается организмом как снижение уровня глюкозы в крови.
Диабет - это выделение глюкозы с мочой. Выделяют две формы диабета:
1) диабет первого типа (диабет молодых людей, он является инсулиндефицитным)
2) диабет второго типа (диабет пожилых или тучных людей, он является инсулинрезистентным или инсулинизбыточным). Эта форма связана с резистентностью инсулиновых рецепторов к инсулину и сопряжена с ожирением, атеросклерозом, гипертонией.
Диабет первого типа возникает в результате абсолютного или относительного дефицита инсулина. Абсолютный дефицит может быть вызван повреждением поджелудочной железы или разрушением в – клеток или островков Лангерганса, что возникает при опухолях, кистозах, травмах, хирургических вмешательствах. Относительный дефицит возникает при несоответствии между инсулиновой продукцией и его потреблением, то есть инсулин выделяется в недостаточном количестве.
Диабет молодых возникает потому, что в детстве углеводный обмен наиболее напряжён.
Сахарный диабет I типа (инсулинозависимый):
Возраст - Молодой, обычно до 30 лет
Начало заболевания - Острое
Уровень кетоновых тел в крови - Часто увеличен
Масса тела - Снижена
Пол - Одинаково часто, но с некоторым перевесом у мужчин
Распространенность - Около 50 % населения
Лечение - Диета, инсулинотерапия
Сахарный диабет II типа (инсулинонезависимый):
Возраст - Старше 40 лет
Начало заболевания - Постепенное (месяцы, годы)
Уровень кетоновых тел в крови - Обычно в норме
Масса тела - Ожирение у 80- 90 % больных
Пол - Чаще у женщин
Распространенность - 2-5 % населения
Лечение - Диета, сахаросни-ающие пероральные препараты
46. Диагностика сахарного диабета подразумевает установление точного диагноза заболевания: установление формы заболевания, оценка общего состояния организма, определение сопутствующих осложнений.
Основными симптомами диабета являются:
1) Избыточное выделение мочи – часто бывает первым признаком диабета. Повышение количества выделяемой мочи обусловлено растворенной в моче глюкозой, препятствующей обратному всасыванию воды из первичной мочи на уровне почек.
2) Сильная жажда – является следствием усиленной потери воды с мочой.
3) Потеря веса – является непостоянным симптомом диабета, более характерным для диабета 1-го типа. Похудание наблюдается даже при усиленном питании больного
Построение гликемической кривой
Принцип метода. Основан на том, что уровень глюкозы в крови обычно характеризует инсулярную функцию. Пероральная нагрузка глюкозой влечет за собой увеличение уровня глюкозы в крови, которая стимулирует инсулярную активность, что приводит к нормализации уровня гликемии. Анализ графического изображения гликемической кривой позволяет выявить скрытые формы диабета и нарушение гликогенобразующей функции печени.
Анализ гликемических кривых: у здорового человека уже через 15 мин после приема глюкозы наблюдается увеличение ее содержания в крови, которое между 30-й и 60-й минутами достигает максимальной величины. Затем начинается снижение и к 120-й минуте содержание глюкозы достигает исходного уровня, отмечавшегося натощак, или с небольшими отклонениями в сторону как повышения, так и снижения. Через 3 ч содержание глюкозы в крови достигает исходной величины.
При сахарном диабете гликемические кривые имеют чрезвычайно высокую вершину и повышенный уровень глюкозы остается спустя 3 ч после нагрузки
При нормальном уровне глюкозы в крови почки полностью её реабсорбируют и сахар в моче не определяется.,если гликемия превышает 9-10 ммоль/л, то появляется глюкозурия. При некоторых поражениях почек глюкоза может обнаруживаться в моче и при нормогликемии.
В норме содержание глюкозы в крови натощак обычно ниже 6 ммоль/л, уровень в пределах 6-8 ммоль/л должен рассматриваться как пограничное состояние, а равный или превышающий 8 ммоль/л может служить диагнозом сахарного диабета. Проверка способности организма регулировать содержание глюкозы в крови используется для диагностики сахарного диабета при постановке перорального глюкозо-толерантного теста:
Первая проба крови берётся натощак после ночного голодания. Затём больному в течение 5 мин. дают выпить раствор глюкозы (75г глюкозы, растворённой в 300 мл воды). После этого каждые 30 мин. на протяжении 2-х часов определяют содержание глюкозы в крови.
Диагностика СД: Концентрация ГЛ больше 7. 2 ммоль/л указывает на СД. И нет необходимости проводить тест толерантности к глюкозе. Наличие гликозилированного Нb. При СД его концентрация увеличивается в 2-3 раза.
Инс и С-пептид секретируются бета- клетками в эквимолярных количествах. В печени задерживается около 60% ИНс, поступающего с кровью воротной вены из поджелуд. железы. Поэтому отношение С-петид/ Инс в воротной вене и периф. кровообращении при н.ус. равно примерно—3/1. С-пептид удаляется обычно через почки его суточная секреция-45 мкг и пропорц. суточной секреции ИНС. Альбуминурия.- ранний признак СД. В норме с мочой-выводится в среднем 8мг А. При выделении 30-300мг, микроальбуминурия.
47. Мальабсорбция (синдром нарушенного всасывания) характеризуется расстройством всасывания в тонкой кишке одного или нескольких питательных веществ и возникновением нарушения обменных процессов. Выделяют первичный (наследственно обусловленный) и вторичный (приобретенный) синдром нарушенного всасывания. Первичный синдром развивается при наследственных изменениях строения слизистой оболочки тонкой кишки и генетически обусловленной ферментопатии. В эту группу входит относительно редко встречающееся врожденное нарушение всасывания в тонкой кишке, обусловленное дефицитом в слизистой оболочке тонкой кишки специфических ферментов-переносчиков. При этом нарушается всасывание моносахаридов и аминокислот (например, триптофана). К этой группе относится и нарушение всасывания белка злаков (пшеницы, ячменя, ржи, овса) - глутена, приводящее к возникновению глутеновой болезни. Из первичных нарушений всасывания у взрослых чаще встречается непереносимость дисахаридов. Вторичный синдром недостаточности всасывания связан с приобретенными изменениями структуры слизистой оболочки тонкой кишки.
48. Метаболизм галактозы в норме и при патологии.
Значительное количество фруктозы, образующееся при расщеплении сахарозы, прежде чем поступить в систему воротной вены, превращается в глюкозу уже в клетках кишечника. Другая часть фруктозы всасывается с помощью белка-переносчика, т.е. путём облегчённой диффузии.
Нарушения метаболизма фруктозы
Недостаточность фруктокиназы клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой, где её можно обнаружить лабораторными методами. Наследственная непереносимость фруктозы, возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу.
Галактоза образуется в кишечнике в результате гидролиза лактозы.
Нарушения метаболизма галактозы
Обмен галактозы особенно интересен в связи с наследственным заболеванием - галактоземией.
Галактоземия возникает при нарушении обмена галактозы, обусловленном наследственным дефектом любого из трёх ферментов, включающих галактозу в метаболизм глюкозы
Это заболевание проявляется очень рано, и особенно опасно для детей, так как основным источником углеводов для них служит материнское молоко, содержащее лактозу. Ранние симптомы дефекта ГАЛТ: рвота, диарея, дегидратация, уменьшение массы тела, желтуха.
Метаболизм фруктозы в норме и при патологии.
Значительное количество фруктозы, образующееся при расщеплении сахарозы, прежде чем поступить в систему воротной вены, превращается в глюкозу уже в клетках кишечника. Другая часть фруктозы всасывается с помощью белка-переносчика, т.е. путём облегчённой диффузии.
Недостаточность фруктокиназы клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой, где её можно обнаружить лабораторными методами. Очень важно не перепутать эту безвредную аномалию с сахарным диабетом. Данное заболевание известно как доброкачественная эссенциальная фруктозурия и встречается с частотой 1:130 000.

Наследственная непереносимость фруктозы, возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу. Рвота, боли в животе, диарея, гипогликемия и даже кома и судороги возникают через 30 мин после приёма пищи, содержащей фруктозу. У маленьких детей и подростков, продолжающих принимать фруктозу, развиваются хронические нарушения функций печени и почек. Непереносимость фруктозы - достаточно частая аутосомно-рецессивная форма патологии.
|
Неактивный фермент |
Блокируемая реакция |
Локализация фермента |
Клинические проявления и лабораторные данные |
|
Фруктокиназа |
Фруктоза + АТФ → Фруктозе-1-фосфат + АДФ |
Печень Почки Энтероциты |
Фруктоземия, фруктозурия |
|
Фруктозе-1-фосфатальдолаза |
Фруктозе-1-фосфат → Дигидроксиацетон-3 -фосфат + Глицеральдегид |
Печень |
Рвота, боли в животе, диарея, гипогликемия, Гипофосфатемия, фруктоземия, гиперурикемия, хроническая недостаточность функций печени, почек. |
49. В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное — главным образом в мышцах. Содержание гликогена в других органах незначительно. Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови в фазе пострезорбции. Поэтому содержание гликогена в печени варьирует в широких пределах. При длительном голодании оно падает почти до нуля, после чего начинается снабжение организма глюкозой с помощью глюконеогенеза Гликоген мышц служит резервом энергии и не участвует в регуляции уровня глюкозы в крови. В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. По этой причине колебания содержания гликогена в мышцах меньше, чем в печени.
Гликогеновые болезни - группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза или распада гликогена, либо нарушение регуляции этих ферментов.
Гликогенозы - заболевания, обусловленные дефектом ферментов, участвующих в распаде гликогена. Они проявляются или необычной структурой гликогена, или его избыточным накоплением в печени, сердечной или скелетных мышцах, почках, лёгких и других органах
Печёночные формы гликогенозов ведут к нарушению использования гликогена для поддержания уровня глюкозы в крови. Поэтому общий симптом для этих форм - гипогликемия в постабсорбтивный период.
Болезнь Гирке (тип I)отмечают наиболее часто. Причина этого заболевания - наследственный дефект глюкозо-6-фосфатазы - фермента, обеспечивающего выход глюкозы в кровоток после её высвобождения из гликогена клеток печени
Гипогликемия - следствие нарушения реакции образования свободной глюкозы из глюкозо-6-фосфата.
Болезнь МакАрдла (тип V) - аутосомнорецессивная патология, при которой полностью отсутствует в скелетных мышцах активность гликогенфосфорилазы.
Агликогеноз (гликогеноз 0 по классификации) - заболевание, возникающее в результате дефекта гликогенсинтазы.
50.Мукополисахаридозы. Группа наследственных заболеваний соединительной ткани, протекающих с поражением нервной системы, глаз, внутренних органов и опорно-двигательного аппарата, возникающих вследствие накопления кислых гликозамингликанов, т. е. мукополисахаридов. Нарушения в обмене приводят к разным симптомокомплексам, имеющим ряд общих клинических проявлений.
Клиническая картина.Выявляется непропорционально малый рост, задержка которого начинается к концу первого года жизни. Обращают на себя внимание грубые черты лица: нависающий лоб, большой язык, гипертелоризм, деформация ушей и зубов. Грудная клетка деформирована, выражен кифоз грудного и поясничного отделов позвоночника. Характерны ограничение подвижности суставов, гепатоспленомегалия, пупочные и паховые грыжи.Появление клинических симптомов после периода нормального развития свойственно большинству болезней накопления. Это связано с достижением критического уровня нерасщепленного субстрата в лизосомах.
Мукополисахаридозы - группа наследственных болезней соединит. ткани, обусловленных нарушением обмена гликозаминогликанов в результате генетически обусловленной неполноценности ферментов, участвующих в их расщеплении. Наследуется по аутосомно-рецессивному типу. При этом поражается система лизосомных ферментов, участвующих в катаболизме гликозаминогликанов. Вследствие ферментативной недостаточности последние накапливаются в большом количестве в органах и тканях, поэтому мукополисахаридозы относят к болезням накопления. В результате нарушается функциональное состояние различных органов и систем, а поскольку гликозаминогликаны входят в состав соединительной ткани, то одним из ведущих проявлений мукополисахаридоза является системное поражение скелета, задержка физического развития. По современной классификации, в зависимости от характера ферментативного дефекта выделяют восемь осн. типов мукополисахаридозов.
51. ЛИПИДАМИ называются сложные органические вещества биологической природы нерастворимые в воде, но растворимые в органических растворителях. ЛИПИДЫ являются основным продуктом питания. Они поступают в организм с продуктами растительного и животного происхождения. Суточная потребность в ЛИПИДАХ для взрослого человека составляет 80-100 гр.

Воска - это сложные эфиры одно- или двухатомных спиртов с количеством углеводных звеньев в цепи 16-35 и ВЖК. Они входят в состав ЛИПИДОВ. В организме человека ЛИПИДЫ представлены:
1. структурными липидами.
2. резервными липидами.
3. свободными липидами - хиломикроны, лпнп, лпонп, лпвп.
ЛИПОПРОТЕИНЫ осуществляют транспорт ЛИПИДОВ от органов и тканей, где они синтезируются к местам их потребления. С их помощью осуществляется транспорт ВЖК и жирорастворимых витаминов A,D, Е, К.
БИОЛОГИЧЕСКАЯ РОЛЬ ЛИПИДОВ.
1 .Структурная. ЛИПИДЫ являются обязательным структурным компонентом биологических мембран клеток.
2.Резервная. ЛИПИДЫ могут откладываться в запас.
3.Энергетическая. Было установлено, что при окислении 1 гр. ЛИПИДОВ до конечных продуктов выделяется 9,3 ккал энергии.
4.Механическая. ЛИПИДЫ подкожной жировой клетчатки, соединительной ткани предохраняют внутренние органы от механических повреждений.
5 .Теплоизолирующая. Защищают организм от переохлаждения и перегревания.
6.Транспортная. ЛИПИДЫ мембран клеток участвуют в транспорте катионов.
7.Регуляторная. Некоторые гормоны являются СТЕРОИДАМИ (АНДРОГЕНЫ, ЭСТРОГЕНЫ, ГЛЮКО- и МИНЕРАЛОКОРТИКОИДЫ), «Местные» гормоны - ПРОСТАГЛАНДИНЫ, ПРОСТАЦИКЛИНЫ, тромбоксаны, лейкотриены образуются в организме из ПОЛИНЕНАСЫЩЕННЫХ ВЖК, входящих в состав ЛИПИДОВ.
8.Участвуют в передаче нервного импульса.
9.Являются источником эндогенной воды. При окислении 100 гр. ЛИПИДОВ выделяется 107гр эндогенной воды.
10.Растворяющая роль. В ЛИПИДАХ растворяются витамины A,D,E, К.
11.Питательная. С пищей в организм поступают незаменимые ВЖК, (ЛИНОЛЕВАЯ, ЛИНОЛЕНОВАЯ, АРАХИДОНОВАЯ).
По функциональной нагрузке в организме различают две группы липидов:
1.Резервные липиды(жиры жировых депо), их количество и состав непостоянны, зависят от режима питания и физического состояния организма.
2 .Структурные
липиды— их количество и состав в
организме строго постоянны, генетически
обусловлены и в норме не зависят от
режима питания, функционального состояния
организма.
.Структурные
липиды— их количество и состав в
организме строго постоянны, генетически
обусловлены и в норме не зависят от
режима питания, функционального состояния
организма.
Триацилглицериды – это сложные эфиры глицерина и высших жирных кислот. Простые триацилглицериды содержат остатки одинаковых, смешанные – разных жирных кислот. Названия триацилглицеридов строятся на основе названий ацильных остатков, входящих в их состав жирных кислот. Смешанные триацилглицериды могут содержать хиральный атом углерода в положении 2 и иметь энантиомеры.Триацилглицериды – малополярные, не растворимые в воде вещества, так как их молекулы не содержат сильнополярных или заряженных групп. Триацилглицериды, содержащие преимущественно остатки ненасыщенных кислот, при обычных условиях являются жидкостями, насыщенных кислот – твердыми веществами. Они входят в состав животных жиров и растительных масел, которые представляют собой смеси триацилглицеридов. Животные жиры содержат в основном триацилглицериды с остатками насыщенных кислот и поэтому имеют твердую консистенцию. Растительные масла включают в основном остатки ненасыщенных кислот и являются жидкостями. Основная биологическая функция триацилглицеридов – запасные вещества животных и растений. Химические свойства триацилглицеридов определяются наличием сложноэфирной связи и ненасыщенностью. Как сложные эфиры триацилглицериды гидролизуются под действием кислот и щелочей, а также вступают в реакцию переэтерификации.
Фосфолипиды – общее название липидов, содержащих остаток фосфорной кислоты. Фосфолипиды – основные липидные компоненты клеточных мембран.
Основные структурные компоненты, составляющие молекулы фосфоглицеридов, – это глицерин, жирные кислоты, фосфорная кислота, аминоспирты (этаноламин или холин) или аминокислота серин. Их рассматривают как производные L-глицеро-3-фосфата в котором спиртовые группы этерифицированы жирными кислотами, а остаток фосфорной кислоты образует сложноэфирную связь с аминоспиртом. При нагревании в кислой и щелочной средах фосфоглицериды гидролизуются, распадаясь на основные структурные компоненты. Основные структурные компоненты молекул фосфосфинголипидов – сфингозин, жирные кислоты, фосфорная кислота, аминоспирты этаноламин или холин. Молекулы фосфолипидов дифильны. Они содержат полярную гидрофильную “голову” и неполярный гидрофобный “хвост”. В водной среде они способны образовывать сферические мицеллы – липосомы, которые можно рассматривать как модель клеточных мембран. Фосфолипиды – основные структурные компоненты клеточных мембран. Согласно жидкостно-мозаичной модели клеточные мембраны рассматриваются как липидные бислои. В таком бислое углеводородные радикалы фосфолипидов за счет гидрофобных взаимодействий находятся внутри, а полярные группы липидов располагаются на внешней поверхности бислоя. В жидкий липидный бислой встроены молекулы белков.
Холесторинважнейший представитель стеринов для которых хароктерно налич.гидроксильной группы в положении 3 и боковой цепи в полож.17.У Х. все кольца наход.в транс-полож.,имеет двойную связь между 5 и 6 углеродн.атомами.Х. содерж.спиртовую гидроксильную группу при С-3 и разветв.алифатическую цепь из 8 атоиов С при С-17.Каждая клетка в организме млекопитающих содерж.Х.Наход.в составе мембран клеок,неэстерифицированный вместе с ФЛ и белками обеспеч.избиратюпроницаемость клеточной мембраны и оказ.регулирулирующеевлияние на сост мембран.В цитоплазме Х. наход в вибе эфиров с ЖК.
52. Фосфолипиды – основные липидные компоненты клеточных мембран. . При гидролизе фосфолипидов образуются фосфорная кислота, жирные кислоты, спирты (глицерин или сфингозин), а также аминоспирты и др. соединения. К фосфолипидам относятся глицерофосфолипиды исфингофосфолипиды
Глицерофосфолипиды (фосфоацилцилглицеролы)являются производными фосфатидной кислоты (фосфатидата).


|
|
|
С труктура
глицерофосфолипидов Наиболее широко
представлен в клетках различных тканей
фосфатидилхолин (лецитин) и
фосфатидилэтаноламин (кефалин). У них
к остатку фосфорной кислоты присоединены
аминоспирты - холин и этаноламин. Эти
два глицерофосфолипида метаболически
тесно связаны друг с другом. Они являются
главными липидными компонентами
большинства биологических мембран. В
тканях находятся также другие
глицерофосфолипиды. В фосфатидилсерине
фосфорная кислота этерифицирована
гидроксильной группой серина, а в
фосфатидилинозите - шестиатомным спиртом
- инозитом.
труктура
глицерофосфолипидов Наиболее широко
представлен в клетках различных тканей
фосфатидилхолин (лецитин) и
фосфатидилэтаноламин (кефалин). У них
к остатку фосфорной кислоты присоединены
аминоспирты - холин и этаноламин. Эти
два глицерофосфолипида метаболически
тесно связаны друг с другом. Они являются
главными липидными компонентами
большинства биологических мембран. В
тканях находятся также другие
глицерофосфолипиды. В фосфатидилсерине
фосфорная кислота этерифицирована
гидроксильной группой серина, а в
фосфатидилинозите - шестиатомным спиртом
- инозитом.
Производное фосфатидилинозита - соединение фосфатидилинозит-4,5-бисфосфат является важным компонентом биологических мембран. При стимуляции соответствующим гормоном он расщепляется. Продукты его расщепления (диацилглицерол и инозитолтрифосфат) служат в качестве внутриклеточных посредников действия гормонов.
С![]()
 глицерофосфолипидами метаболически
очень тесно связаны лизофосфолипиды.
В их составе содержится только один
остаток жирной кислоты. Примером может
служить лизофосфатидилхолин, который
играет важную роль в метаболизме
фосфолипидов.
глицерофосфолипидами метаболически
очень тесно связаны лизофосфолипиды.
В их составе содержится только один
остаток жирной кислоты. Примером может
служить лизофосфатидилхолин, который
играет важную роль в метаболизме
фосфолипидов.
![]()
Лизофосфатидилхолин способен вызывать лизис эритроцитов. Поэтому наличие в змеином яде большого количества лизофосфолипидов является причиной гемолиза, который наблюдается при укусах змей. Молекулы фосфолипидов дифильны. Они содержат полярную гидрофильную “голову” и неполярный гидрофобный “хвост”. В водной среде они способны образовывать сферические мицеллы – липосомы, которые можно рассматривать как модель клеточных мембран. Фосфолипиды – основные структурные компоненты клеточных мембран. Согласно жидкостно-мозаичной модели клеточные мембраны рассматриваются как липидные бислои. В таком бислое углеводородные радикалы фосфолипидов за счет гидрофобных взаимодействий находятся внутри, а полярные группы липидов располагаются на внешней поверхности бислоя. В жидкий липидный бислой встроены молекулы белков. Биосинтез ФЛ происходит в печени,стенке кишечника,семенниках,яичниках,молоч.железе.Наиболее важные ФЛ синтез.в эндоплазм.сети клктки.Центр.роль в биосинтазе ФЛ играет 1,2-диглицерид,а такжецитидинтрифосфат участ.в синтазе ФЛ.
Фосфолипиды являются основным структурным компонентом клеточных мембран. Входят в состав ЛП крови, сурфактанта, Они содержат остаток фосфорной кислоты. Различают глицерофосфолипиды, сфинголипиды, гликолипиды

В составе фосфолипидных мембран преобладают полиненасыщенные ЖК. Церамиды – гликолипиды (цереброзиды, ганглиозиды). Содержат в своем составе углеродный компонент (глюкоза). Сфингомиелины – производные сфингозина. Являются основными компонентами миелина и мембран клеток мозга и нервной ткани. Ганглиозиды являются компонентами мембран эритроцитов, гепатоцитов
53. Биологическая ценность липидов пищи. Переваривание, всасывание и ресинтез липидов в органах пищеварительной системы.
Структурная. ЛИПИДЫ являются обязательным структурным компонентом биологических мембран клеток.
Резервная. ЛИПИДЫ могут откладываться в запас.
Энергетическая. При окислении 1 гр. ЛИПИДОВ до конечных продуктов выделяется 9,3 ккал энергии.
Механическая. ЛИПИДЫ подкожной клетчатки, соед. ткани предохраняют внутренние органы от повреждений.
Теплоизолирующая. Защищают организм от переохлаждения и перегревания.
Транспортная. ЛИПИДЫ мембран клеток участвуют в транспорте катионов.
Регуляторная. Некоторые гормоны являются СТЕРОИДАМИ (АНДРОГЕНЫ, ЭСТРОГЕНЫ, ГЛЮКО- и МИНЕРАЛОКОРТИКОИДЫ), «Местные» гормоны - ПРОСТАГЛАНДИНЫ, ПРОСТАЦИКЛИНЫ, тромбоксаны, лейкотриены образуются в организме из ПОЛИНЕНАСЫЩЕННЫХ ВЖК, входящих в состав ЛИПИДОВ.
Участвуют в передаче нервного импульса.
Являются источником эндогенной воды. При окислении 100 гр. ЛИПИДОВ выделяется 107гр эндогенной воды.
Растворяющая роль. В ЛИПИДАХ растворяются витамины A,D,E, К.
Питательная. С пищей в организм поступают незаменимые ВЖК (ЛИНОЛЕВАЯ, ЛИНОЛЕНОВАЯ, АРАХИДОНОВАЯ).
ПЕРЕВАРИВАНИЕ ЛИПИДОВ.
Поступающие с пищей ЛИПИДЫ в ротовой полости подвергаются только механической переработке. Переваривание жиров у взрослого человека будет происходить в кишечнике, где для этого имеются все условия:
1. Наличие желчных кислот.
2. Наличие ферментов.
3. Оптимальная рН среды.
У детей до 1 года в кишечнике выделяется ЛИПАЗА, рН оптимум которой = 5-5,5. Под влиянием этого фермента расщепляются только жиры молока. У взрослого человека она не активна. Переваривание жиров в желудке не происходит (в норме).
Переваривание ЛИПИДОВ пищи в кишечнике происходит при наличии вышеуказанных условий. При поступлении пищи из желудка в 12перстную кишку в слизистой оболочке тонкой кишки начинают выделяться регуляторы: секретин, холецистокинин, ХИМОДЕНИН, ИНТЕРОКЛИИН. Они обеспечивают: образование желчи в печени, сокращение желчного пузыря, выделение панкреатического сока, секрецию желез тонкого кишечника. Всё это обеспечивает быстрое переваривание пищи. Особую роль в переваривании играют желчные кислоты. Все они образуются в печени и являются конечным продуктом окисления холестерина в организме.
ЖЕЛЧНЫЕ КИСЛОТЫ .ХОЛЕЦИСТОКИНИН, ХИМОДЕНИН, ИНТЕРОКЛИИН. Они обеспечивают:
образование желчи в печени,
сокращение желчного пузыря,
выделение панкреатического сока,
секрецию желез тонкого отдела кишечника.
О собую
роль в переваривании играют желчные
кислоты. В основе их строения лежит
структура ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕН.
собую
роль в переваривании играют желчные
кислоты. В основе их строения лежит
структура ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕН.
По своей химической природе все желчные кислоты являются производными ХОЛЕВОЙ К-ТЫ. Если у ХОЛЕВОЙ кислоты присутствует две группы в 3 и 7 положениях, то её называют ХЕНОДЕЗОКСИХОЛЕВОЙ. Если присутствует две группы в 3 и 12 положении, то она называется ДЕЗОКСИХОЛЕВОЙ. Если одна группа в 3 положении, кислота называется ЛИТОХОЛЕВАЯ.
БИОЛОГИЧЕСКАЯ РОЛЬ ЖЕЛЧНЫХ КИСЛОТ:
1. Эмульгируют пищевые жиры.
2. Активируют ЛИПОЛИТИЧЕСКИЕ ферменты.
3. Выполняют роль переносчиков трудно растворимых в воде продуктов гидролиза жира и жирорастворимых витаминов A,D, Е, К. При ЭМУЛЬГИРОВАНИИ жир дробится на мелкие частички. Желчные кислоты адсорбируются на поверхности жира, препятствуя слиянию частичек жира. В результате происходит стабилизация жира и значительно увеличивается поверхность контактов с ЛИПОЛИТИЧЕСКИМИ ферментами. Стабилизированная эмульсия жира далее подвергается гидролизу под влиянием панкреатических ферментов (ЛИПАЗ, ФОСФОЛИПАЗ).
Желчнокаменная болезнь– патологический процесс, при котором в желчном пузыре образуются камни. Избыток ХС и недостаток желчных кислот приводит к осаждению ХС в виде ХС или смешанных камней (ХС+билирубин+Са) Факторы:избыток ХС в пище, гиперкалорийное питание, застой желчи, нарушение синтеза желчных кислот, нарушение обмена липопротеинов
Для последующего всасывания ТАГ сначала должны подвергнуться ферментативному гидролизу до свободных жирных кислот (СЖК) и моноацилглицеролов (МАГ). Гидролиз, хотя и в очень малой степени, начинается в желудке под действием кислой липазы. Этот фермент секретируется слюнными железами и клетками слизистой желудка. Оптимальной средой для её действия является среда, близкая к нейтральной. Поэтому липаза в желудке взрослого человека практически неактивна из-за низких значений рН, которые там имеют место в норме. Тем не менее, её действие способствует эмульгированию жира в химусе и, тем самым, увеличению площади раздела двух фаз - жира и воды.У взрослого человека основным местом переваривания липидов является тонкий кишечник. В двенадцатиперстной кишке происходит нейтрализация попавшей в кишечник с пищей соляной кислоты желуд.сока бикарбонатами желчи и сока поджелудочной железы,выделяющиеся при разложении бикарбонатов пузерькиСО2 способ. Хорошему перемеш пищевой кашица с пищеваритюсоками.. На первом этапе там происходит эмульгирование жира. Эмульсия представляет собой взвесь в водной среде частиц неполярных липидов. По сути дела эмульгирование заключается в дроблении крупных липидных частиц на более мелкие. Происходит этот процесс благодаря трем факторам: 1) перистальтика кишечника, которая способствует перемешиванию и дроблению жировых капель; 2) углекислому газу. Он образуется в результате реакции нейтрализации гидрокарбонатов кишечного сока кислым содержимым желудка, поступающим туда с пищей; 3) желчным кислотам.Всасывание происход.в проксимальной части тонкой кишки.Тонкоэмульгированые жиры частично могут всасываться через стенки кишечника без предвал.гидролиза.Основ.часть жира всасывается лишь после ращепления его панкреат.липазой на ЖК,моноглицериды и глицерин.Процесс всасывания ЖК с длинной углеродной цепью и моноглицеридов осущ.при участии желчи и желных кислот.ЖК с короткой углерод.цепью и глицерин ,будучи хорошо растворимыми в воде,свободно всасываются в кишечнике и поступ.в кровь воротной вены ,оттуда в печень,минуя какое-либо превращение в кишечном тракте.
Особенности переваривания липидов у детей.
Важную роль в пищеварении у детей играет расщепление триглицеридов в желудке, особенно грудного возраста. Слизистая оболочка корня языка и примыкающей к нему области глотки ребенка грудного возраста секретирует собственную липазу в ответ на сосательные и глотательные движения (при кормлении грудью). Эта липаза получила название лингвальной. Активность лингвальной липазы не успевает «проявиться» в полости рта, и основным местом ее воздействия является желудок. Оптимум рН лингвальной липазы в пределах 4,0–4,5; он близок к величине рН желудочного сока у таких детей. Лингвальная липаза наиболее активно действует на триглицериды, содержащие жирные кислоты с короткой и средней длиной цепи, что характерно для триглицеридов молока. Иными словами, жир молока – самый подходящий субстрат для этого энзима. У взрослых активность лингвальной липазы крайне низкая.
Желчные кислоты – продукты конечного метаболизма холестерина. В печени образуются холевая и хенодезоксихолевая кислоты (первичные), затем, под действием бактерий кишечника они переходят в дезоксихолевую и литохолевую. Кроме того, желчные кислоты конъюгируют с глицином или с таурином и образуют гликохолевую, таурохолевую, гликодезоксихолевую и т.д. Желчные кислоты, как амфифильные соединения, ориентируются на границе жир-вода, погружаясь гидрофобной частью молекулы в жир, а гидрофильной – в воду. Это приводит к снижению поверхностного натяжения и дроблению капель жира. В итоге увеличивается общая поверхность капель жира, что увеличивает контакт жира с ферментами (по закону адсорбции), растворенными в водной среде.После гидролиза липидов и образования жирных кислот для их всасывания в кишечнике желчные кислоты образуют конъюгаты с жирными кислотами и обеспечивается транспорт такого комплекса через мембрану эпителиальных клеток. Желчные кислоты (кроме литохолевой) и их конъюгаты постоянно участвуют в печеночно-кишечном цикле (энтеро-портальная рециркуляция). Одна молекула желчной кислоты может за сутки проходить 5 – 15 циклов.Литохолевая кислота, при первом же попадании в печень связывается с серной кислотой и более не возвращается в портальную систему, а экскретируется с фекалиями.
Все ферменты, принимающие участие в гидролизе липидов
растворены в водной фазе содержимого тонкого кишечника и могут действовать на молекулы липидов лишь на границе раздела липид/вода. Отсюда , для эффективного переваривания липидов необходимо увеличение этой поверхности с тем, чтобы большее количество молекул ферментов участвовало в катализе. Увеличение площади поверхности раздела достигается за счет эмульгирования липидов – разделение крупных липидных капель пищевого комка на мелкие. Происходит этот процесс благодаря трем факторам: 1) перистальтика кишечника, которая способствует перемешиванию и дроблению жировых капель; 2) углекислому газу. Он образуется в результате реакции нейтрализации гидрокарбонатов кишечного сока кислым содержимым желудка, поступающим туда с пищей; 3) желчным кислотам. В результате поверхность частицы приобретает суммарный электрический заряд, который будет одноименным у всех других эмульсионных частиц. В силу электростатического взаимодействия между отдельными частицами возникает отталкивание.
Для эмульгировани необходимы поверхностно-активные вещества – ПАВы, представляющие собой амфифильные соединения , одна часть молекулы которых гидрофобна и способна взаимодействовать с гидрофобными молекулами поверхности липидных капель, а вторая часть молекулы ПАВов должна быть гидрофильной, способной взаимодействовать с водой. При взаимодействии липидных капель с ПАВами снижается величина поверхностного натяжения на границе раздела липид/вода и крупные липидные капли распадаются на более
мелкие с образованием эмульсии. В качестве ПАВов в тонком кишечнике выступают соли ЖК и продукты неполного гидролиза триацилглицеринов или ФЛ, однако основную роль в этом процессе играют желчные кислоты.Наиболее эффективное эмульгирование жиров происходит при комбинированном действии на капельки жира трех веществ: солей жёлчных кислот, ненасыщенных жирных кислот и моноацилглицеролов. При таком действии поверхностное натяжение частиц жира на разделе фаз жир/вода резко уменьшается. Крупные частицы жира распадаются на мельчайшие капельки. Мелкодисперсная эмульсия, содержащая указанную комбинацию эмульгаторов, очень стабильна, и укрупнения частичек жира не происходит. Совокупная поверхность капелек жира очень велика. Это обеспечивает большую вероятность взаимодействия жира с ферментом липазой и гидролиз жира.
Основным ферментом, который катализирует расщепление липидов пищи, является панкреатическая липаза. Этот фермент присутствует в соке поджелудочной железы и активируется в просвете кишечника. Дело в том, что в водной среде доступ к активному центру липазы заблокирован -спиральным участком её молекулы. На границе раздела жир-вода активный центр становится доступен для субстратов. Этому способствует также специальный белок, названный колипазой. Колипаза связывается с С-концом некаталитического участка молекулы панкреатической липазы. Происходящее вслед за этим изменение конформации обусловливает прикрепление ферментативного комплекса к липидной поверхности эмульсионных частиц. Активный фермент ускоряет реакцию гидролиза ацилглицеролов. Оптим. каталитич. активность липаз проявляется при рН 8-9. Однако нек-рые липазы растений и микроорганизмов активны в слабокислой среде (рН 4-6).
ЛипопротеидыРазличают следующие классы липопротеиновых частиц: 1) хиломикроны - d<1,00г/мл кл. кишечника, перенос экзо. жира из кишечника в ткани, транспорт экзо-о хол-а из кишечника в печень. ; 2) липопротеины очень низкой плотности - d<1,006г/мл- печень, транспорт эндогенного жира, синтезированного в печени из углеводов, в жировую ткань; 3) липопротеины промежуточной плотности - d=1,006-1,020г/мл; 4) липопротеины низкой плотности - d=1,02-1,063г/мл- образуются в кровеносном русле из ЛОНП через стадию образования Липопротеинов Промежуточной Плотности (ЛПП), транспорт эндогенного холестерина в ткани; 5) липопротеины высокой плотности - d=1,063-1,210г/мл- печень, транспорт холестерина из тканей в печень и выводится с желчью. ЛПОНП называются пре -липопротеины, ЛПНП - -липопротеины, а ЛПВП - -липопротеины.
Все липопротеины плазмы крови являются частицами сферической формы, состоящими из ядра, включающего в себя триацилглицеролы и эфиры холестерола, окруженного тонким липидным монослоем молекул свободного холестерола и фосфолипидов. Аполипопротеины внедрены в поверхностную липидную оболочку таким образом, что их гидрофобные домены - в сторону ядра, а гидрофильные - наружу. Такая конфигурация является высоко устойчивой и облегчает растворимость микрокапель неполярных липидов.
Характеристика липопротеинов плазмы крови. Липопротеины\Источник\Диаметр нм\Плотность\%белка\%липиды\ % от общего количества липидов: ТАГ и ЭХ.Хиломикроны \Кишечник\90 – 1000\< 0,95\1 – 2\98 – 99\88и3. ЛПОНП печень\30 – 90\0,95-1,006\7 – 10\90 – 93\56и15. ЛППП\ ЛПОНП\25 – 30\1,006-1,009 \11\89\29и34. ЛПНП \ ЛПОНП\20 – 25\1,019-1,063\21 \79\ 13 и 48. ЛПВП2\печень\10 – 20\1,063-1,125\33\67\16и31 . ЛПВП3 \?\7,5 – 10\ 1,125-1,210\ 57\ 43\ 13и29
ФУНКЦИИ АПОБЕЛКОВ.1. Апобелки выполняют функцию эмульгаторов, потому что являются амфифильными веществами. 2. Некоторые из аполипопротеинов являются регуляторами активности ферментов липидного обмена.3. Могут обладать собственной ферментативной активностью.4.Могут выступать в качестве лигандов клеточных рецепторов для липопротеинов.5.Многие апобелки осуществляют транспорт липидов из одного липопротеина в другой.Характеристика Апопротеин| Липопротеин| Мол. Масса| Свойства. А - I. \ ЛПВП, хиломикроны\28.000 \Активатор ЛХАТ.A – II\ ЛПВП, хиломикроны\17.000\ Два одинаковых мономера, связанных через дисульфидный мостик.B – 100\ ЛПНП, ЛПОНП, ЛППП\ 550.000\Лиганд для рецептора к ЛПНП; синтезируется в печени.B – 48\ Хиломикроны и обломки хиломикронов\260.000 \Синтезируется в кишечнике.C - I \ЛПОНП, ЛПВП\7.600 \Возможный активатор ЛХАТ (?).C - II \ЛПОНП, ЛПНП, хиломикроны\8.800\ Активатор внепеченочной липопротеинлипазы.C – III\ ЛПОНП, ЛПВП, хиломикроны\8.750 \Различные формы, содержащие сиаловую кислоту.D \ЛПВП\ -\ Белок, переносящий ЭХ.E\ ЛПОНП, ЛПВП, хиломикроны, обломки хиломикронов\-\ Лиганд для рецепторов, взаимодействующих с обломками ХМ.
54. Выделяют 4 класса ЛИПОПРОТЕИНОВ крови:
1. ХИЛОМИКРОНЫ. Образуются в стенке кишечника и имеют самый крупный размер частиц.
2. ЛПОНП. Синтезируются в стенке кишечника и печени.
3. ЛПНП. Образуются в эндотелии капилляров из ЛПОНП.
4. ЛПВП. Образуются в стенке кишечника и печени.
Т.о. транспортные ЛП крови синтезируются двумя видами клеток - ЭНТЕРОЦИТАМИ и ГЕПАТОЦИТАМИ.
Максимальная концентрация хиломикронов достигается к 4 - 6 часам после приёма пищи. Принято считать, что ХИЛОМИКРОНЫ отсутствуют в крови натощак и появляются только после приёма пищи. В основном они транспортируют ТРИГЛИЦЕРИДЫ (83 - 85 %).
ЛПОНП и ЛПНП в основном транспортируют холестерин и его эфиры в клетки органов и тканей. Эти фракции относятся к АТЕРОГЕННЫМ. ЛПВП в основном осуществляют транспорт ФОСФОЛИПИДОВ и ХОЛЕСТЕРИНА. Холестерин транспортируется в печень для последующего окисления с образованием желчных кислот и выделяется из организма в виде КОПРОСТЕРИНОВ. Эту фракцию называются АНТИАТЕРОГЕННОЙ.
На этапе обмена холестерина наиболее частым заболеванием является АТЕРОСКЛЕРОЗ. Болезнь развивается тогда, когда между клетками тканей и ЛП крови растёт содержание АТЕРОГЕННЫХ ФРАКЦИЙ и понижается содержание ЛПВП, назначение которых удалять холестерин из клеток тканей в печень для последующего его окисления. Все ЛП за исключением ХИЛОМИКРОНОВ быстро метаболизируются. ЛПНП задерживаются в сосудистой стенке. Они содержат много ТРИГЛИЦЕРИДОВ и ХОЛЕСТЕРИНА. Они, фагоцитируясь, разрушаются ферментами ЛИЗОСОМ, за исключением холестерина. Он накапливается в клетке в большом количестве. Клетки разрушаются и гибнут. Холестерин откладывается в межклеточном пространстве и инкапсулируется соединительной тканью. В сосудах образуются АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ.
Для оценки угрозы развития атеросклероза кроме уровня общего холестерина необходимо знать коэффициент атерогенности, который должен быть ≤3. Если коэффициент атерогенности больше 3, значит в крови много «плохого» холестерина, имеется угроза развития атеросклероза.
55. Роль рецептора ЛПНП в развитии гиперхолестеринемии.
Рецептор липопротеина низкой плотности играет важную роль в контроле уровня холестерина в плазме крови человека. Локализуясь на поверхности гепатоцитов и других клеток, рецептор связывает липопротеины низкой плотности, холестерол-транспортные протеины, обеспечивая их вхождение внутрь клетки путем эндоцитоза. Внутри клетки липопротеины низкой плотности деградируют внутри лизосом и высвобожденный холестерол может быть метаболизирован для синтеза мембран, стероидных гормонов и т.д.Рецептор ЛПНП представляет собой одноцепочечный трансмембранный белок, имеющий пять различных доменов: связывающий лиганд, гомологичный предшественнику эпидермального фактора роста, содержащий О-связанные сахара, пронизывающий мембрану и цитоплазматический. Домен связывающий лиганд включает семь повторяющихся обогащенных цистеином отрицательно заряженных последовательностей, которые взаимодействуют с положительно заряженными участками апо В, содержащими большое количество аргининов и лизинов . Цитоплазматический домен обеспечивает связывание рецептора с окаймленной ямкой . Рецепторы синтезируются рибосомами шероховатого эндоплазматического ретикулума и гликозилируются в аппарате Гольджи . Мутации гена, кодирующего рецептор ЛПНП и локализованного в коротком плече хромосомы 19 , приводят к нарушению процесса деградации ЛПНП, что является причиной возникновения СГХС.
Атеросклероз. С позиции инфильтрационной теории основным действующим фактором, вызывающим образование и развитие атеросклеротических изменений в стенке сосуда является ХС ЛПНП. Этот класс ЛП подвергается значительным изменениям в зависимости от питания, условий внешней и внутренней среды. Меняется не только липидный, но и апопротеиновый состав, заряд, жесткость ЛП- частицы. При этом заметно нарастает содержание иммуноглобулина LgG. Апо-В содержащие ЛП (ЛПНП и ЛПОНП) образуют растворимые комплексы с ГАГ соединительнотканного матрикса аретрий, приводя к структурным изменениям стенки сосуда. Такое изменение структуры и конформации ЛП вызывает активацию перекисного окисления липидов, входящих в состав ЛП. Экзогенные вещества, также как и перекиси липидддов, могут с одной стороны вызывать конформационные изменения апоаротеинов, а сдругой служить гаптенамит. Не исключено появление в составе ЛП фенотипов апопротеинов или их мутантных форм. Антитела к ЛП появляются в 2х случаях: в отвте на модифицированные in vivo ЛП, которые приобретают аутогенные свойства, и , во-вторых в ответ на воздейтсвие патогенных или других факторов, когда клетки иммунокомпетентной системы синтезируют антитела, образующие иммунные комплексы с нативными плазменными ЛП. В обоих случаях образуется иммунный комплекс ЛП-антитело, который рассматривается как модифицированный ЛП , иначе реагирующий с клеткой, чем нативный ЛП. Физиологический смысл формирования иммунного комплекса необходим для более быстрого удаления антигена из крови. Иммунный комплекс ЛПНП-LgG захватывается макрофагами на 23% активнее, чем нативные ЛП. Избыточный захват иммунных комплексов ЛП- антитело макрофагами приводит к превращению последних в пенистые клетки, играющие важную роль в развитии атеросклеротичесмких поражений артерий ( ксантоматоз, регрессирование и стадии атеросклероза). Появление пенистых клеток во внутренней оболочке артерий является характерным морфологическим признаком прогрессирующего атеросклеротического процесса. Ускоренному образовании. Пенистых клеток способствует специфический набор рецепторов ( рецепторы к ЛПОНП и ЛППП, рецепторы к комплексу ЛПОНП с ГАГ и д.р.) Гибель пенистых клеток приводит к выходу в межклеточное пространство липидов. Таким образом липидоз интимы происходит одновременно как за счет ЛП, поступающих их плазмы, так и за счет освобождения из пенистых клеток ХС. Накопление последних сопровождатеся очаговым склерозом, образованием пятен и полос, являющихся основой для фиброзных бляшек.
Дислипопротеинемии-изменение соотношения классов ЛП в крови (нарушение липидного профиля плазмы) – это гипо и гиперхолестеринемии. Классификация дислипопротеидемий: выделяют следующие типы - Iтип — нормальный или несколько повышенный уровень ОХС, резко повышенный уровень ТГ;IIAтип — резко повышенный уровень ОХС, нормальное содержание ТГ;IIBтип — резко повышенный уровень ОХС и умеренно повышенный уровень ТГ;IIIтип — резко повышенные уровни ОХС и ТГ;IVтип — нормальное или умеренное содержание ОХС, повышенная концентрация ТГ ;Vтип — нормальный или несколько повышенный уровень ОХС, резко повышенный уровень ТГ на фоне сахарного диабета. Наиболее высокий индекс атерогенности отмечают приIIBтипе. ДЛПIIIтипа часто ассоциируется со смешанным атеросклерозом, ДЛПIIBиIVтипа — с ожирением, снижением уровня тестостерона в крови, повышением содержания кортизола. ДЛПIIA,IIB,IIIиIVтипа, как правило, сопровождаются гиперинсулинемией. Классификация по Фредриксону: первичные наследственные гипо и приобретенные вторично состояния. Наиболее распространены гиперлипопротеидемии с повышением уровней общего холестерина, холестерина ЛПНП и триглицеридов.
56. В постабсорбционном состоянии основным энергетическим "топливом" для клеток являются высшие ЖК (поступающая в клетки глюкоза превращается в жирные кислоты). При поступлении глюкозы в клетки она в цитозоле окисляется до пирувата ,последний окисляется в матриксе митохондрий до ацетил-КоА. Образовавшийся ацетил-КоА конденсируется с оксалоацетатом (ЩУК) с образованием цитрата, а цитрат выходит из митохондрии в цитозоль. Поступивший в цитозоль цитрат, во-первых, служит источником ацетил-КоА и восстановительных эквивалентов для синтеза высших жирных кислот, а, во-вторых, активирует фермент ацетил-КоА-карбоксилазу, стимулируя тем самым образование малонил-КоА, также необходимого для синтеза высших жирных кислот. В результате при избытке глюкозы в клетке запускается синтез жирных кислот. Малонил-КоА в свою очередь угнетает перенос высших жирных кислот из цитозоля в матрикс митохондрий, ингибируя активность внешней ацетил-КоА: карнитин-ацилтрансферазы, выключая таким образом окисление высших жирных кислот. В итоге при поступлении глюкозы в клетку угнетается окисление высших жирных кислот, стимулируется их синтез, а потребность клетки в энергии покрывается за счет аэробного окисления глюкозы, чему способствует повышение концентрации ацетил-КоА и цитрата в матриксе митохондрий. Увеличение концентрации жирных кислот в клетке наряду с нарастанием концентрации в них триозофосфатав создает условия для синтеза резервных триглециридов. В этот процесс включаются также высшие жирные кислоты и глицерол, поступающие в клетку в результате гидролиза триглицеридов ХМ и ЛПОНП. Основная роль карнитина – активное расщепление жиров и обеспечение организма необходимой энергией: L-карнитин доставляет жирные кислоты в митохондрии клеток, где они достаточно быстро подвергаются окислительной реакции.
Б иосинтез
триглицеридов
иосинтез
триглицеридов
Синтез триглицеридов в тканях происходит с учетом двух путей образования глицерол-3-фосфата и возможности синтеза триглицеридов в стенке тонкой кишки из в-моноглицеридов, поступающих из полости кишечника в больших количествах после расщепления пищевых жиров. Существуют глицерофосфатный, дигидроксиацетонфосфатный и в-моноглицеридный пути синтеза триглицеридов. Большинство ферентов, участвующих в биосинтезе ТГ, находятся в эндоплазматическом ретикулуме, но некоторые, например глицерол-3-фосфатацилтрансфераза, находятся в митохондриях.
Липаза жировой ткани – является цАМФ-зависимым ферментом. Гормоны, увеличивающие концентрацию цАМФ, усиливают липолиз.
Все гормоны, влияющие на мобилизацию жира, можно разделить на 2 группы
Гормоны прямого действия (адреналин, соматотропный гормон гипофиза, инсулин).
Гормоны косвенного действия (глюкокортикостероиды, половые гормоны, лептин).
АДРЕНАЛИН
Мембраны адипоцитов содержат адренорецепторы двух типов (и). Взаимодействие адреналина с рецепторами обоих типов вызывает изменение концентрации цАМФ. Однако, это влияние разнонаправленное.
-адренорецептор связан с ингибирующим G-белком (Gi), свызывающим понижение активности аденилатциклазы. Это приводит к уменьшению концентрации цАМФ, и, в конечном счете, торможению липолиза.
-адренорецептор связан со стимулирующим G-белком (Gs) – эффектом будет стимуляция липолиза.
Соотношение - и-адренорецепторов зависит от индивидуальных особенностей организма. Это касается как организма в целом, так и распределения этих рецепторов в разных частях тела – поэтому в процессе липолиза разные части тела у разных людей «худеют» неодинаково. Однако в целом у человека преобладают-адренорецепторы, поэтому суммарное действие адреналина приводит к активации липолиза.
СОМАТОТРОПНЫЙ ГОРМОН – стимулирует липолиз, воздействуя через аденилатциклазную систему.
Действие ИНСУЛИНА связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации.
ГЛЮКОКОРТИКОСТЕРОИДЫ: рецепторы к этим гормонам присутствуют в адипоцитах и содержат в своем составе белки теплового шока. После взаимодействия гормона с рецептором белки теплового шока отделяются, а сам комплекс транспортируется в ядро клетки, где влияет на синтез белков адипоцита. Конкретные механизмы влияния не до конца выяснены и находятся в стадии изучения. В итоге глюкокортикостероиды оказывают двоякое действие: на фоне мышечной работы они стимулируют липолиз, а в состоянии покоя – ингибируют его. Установлено, что при развитии опухоли коры надпочечников или при введении высоких доз препаратов глюкокортикостероидов, наблюдается рост жировых запасов на лице и в верхней части туловища (синдром Иценко-Кушинга).
ПОЛОВЫЕ ГОРМОНЫ: точный механизм их воздействия на жировой обмен пока не выяснен, но известно, что действуют эти гормонов связано со стимуляцией синтеза определенных белков. Действие половых гормонов однонаправленное: стимуляция распада жира. Ярким примером является действие тестостерона. Кастрация приводит к увеличению запасов жира.
ЛЕПТИН(от лат.Leptos– тонкий, худой). По химической природе – полипептид, синтезируется в адипоцитах. Лептин – гормон жировой ткани (поэтому жировую ткань можно отнести к эндокринным). Рецепторы к лептину расположены в гипоталамусе и в тканях репродуктивной системы. Лептин снижает выработку нейропептидаY, который вызывает повышение аппетита и усиливает синтез жира (точные механизмы воздействия пока неясны).Лептин также стимулирует выработку разобщающих белков бурого жира. Суммарный эффект лептина: снижение аппетита и усиление липолиза. Концентрация лептина в крови пропорциональна количеству жировых клеток. Поэтому, можно считать, что лептин передает в головной мозг информацию о количестве жира в организме. Лептин также усиливает репродуктивную функцию человека. В настоящее время ведутся работы над созданием рекомбинантного лептина для лечения ожирения.
57. Окисление ВЖК в тканях изучалось Ф. КНООПОМ (1904г.), который назвал окисление ВЖК бета- окислением. Он показал, что процесс этот циклический.В настоящее время бета-окисление называют ЦИКЛОМ КНООПА - ЛИНЕНА. Транспорт ВЖК внутрь возможно только при участии КАРНИТИНА. АЦЕТИЛ-КОА в цитоплазме соединяется с КАРНИТИНОМ при участии фермента АЦЕТИЛ-КОА-КАРНИТИНТРАНСФЕРАЗЫ. Образуется комплекс, который легко проникает через мембрану. В межмембранном пространстве уже при участии МИТОХОНДРИАЛЬНОЙ ТРАНСФЕРАЗЫ комплекс распадается. КАРНИТИН возвращается в цитоплазму, а ВЖК в матрице подвергается окислению.


![]()
При
бета -окислении выделилось 5АТФ и 12АТФ
выделилось при окислении АЦЕТИЛ-КОА в
ЦТК и сопряженных с ним ферментов
дыхательной цепи. Окисление ВЖК будет
происходить циклически одинаково, но
только до последней стадии - стадии
превращения масляной кислоты (БУТИРИЛ-КОА),
которая имеет свои особенности.


58. Окисление ненасыщенных ЖК.Ненасыщенные ЖК имеют в своей структуре двойные или тройные углерод-углеродные связи, причем тройные связи встречаются крайне редко. Ненасыщенные жирные кислоты, в свою очередь, делятся на моноеновые, т.е. содержащие 1 кратную связь, и полиеновые - содержащие несколько кратных связей (диеновые, триеновые и т.д.). Все природные ненасыщенные жирные кислоты имеют стереохимическую цис-конфигурацию. Природные ненасыщенные жирные кислоты обычно имеют тривиальные названия: олеиновая, линолевая, линоленовая, арахидоновая и др. кислоты. Функции ЖК: 1) энергетическая функция, так как именно при их окислении выделяется основная масса энергии 2)с труктурную функцию, поскольку они входят в состав разнообразных более сложных по химическому строению липидов, таких как триацилглицерины или сфинголипиды. 3) пластическую 4) ряд полиненасыщенных высших жирных кислот относятся к незаменимым компонентам пищи, поскольку они не синтезируются в организме. Обычно к эссенциальным высшим жирным кислотам относят линолевую, линоленовую и арахидоновую кислоты. Приокисленииненасыщенных жирных кислот, например, олеиновой или пальмитоолеиновой, имеющаяся в их составе двойная углерод-углеродная связь постепенно смещается к карбоксильному концу молекулы и в результате нескольких циклов b -окисления образуется еноил-КоА в котором, во-первых, двойная связь находится между третьим и четвертым атомами углерода, а, во-вторых, эта двойная связь имеет цис-конфигурацию. Однако в клетках есть фермент из класса изомераз, который переводит двойную связь в углеродном радикале кислоты из положения 3,4 в положение 2,3 и изменяет цис-конфигурацию относительно двойной связи на транс-конфигурацию. За счет действия этой изомеразы преодолеваются стереохимические затруднения, возникающие при окислении ненасыщенных жирных кислот.
59. Реакция синтеза и утилизация ацетил-КоА
![]()
![]()
Ацетон, который образуется при спонтанном (неферментативном) декарбоксилировании ацетоацетата, в организме не используется. Он выводится с выдыхаемым воздухом, секретом потовых желёз и мочой. В норме концентрация ацетона в крови мала и обычными реакциями не определяется.
Кетоновые тела синтезируются в печени, легко проходят через митохондриальные и клеточные мембраны и поступают в кровь. Кровью они транспортируются во все другие ткани. Используются только ацетоацетат и бета-гидроксибутират.
