- •2. Аминокислоты, входящие в состав белков, их строение и свойства. Пептиды.
- •4. Вторичная структура белков. Связи, стабилизирующие вторичную структуру.
- •5. Третичная структура белков. Типы химических связей, участвующих в
- •8. Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация. Денатурация, признаки и факторы ее вызывающие.
- •1. Различия белков по форме молекул
- •2. Различия белков по молекулярной массе
- •3. Суммарный заряд белков
- •4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков
- •5. Растворимость белков
- •1. Методы разрушения тканей и экстракции белков
- •2. Методы очистки белков
- •3. Очистка белков от низкомолекулярных примесей
- •10. Принципы классификации белков. Классификация по составу и биологическим функциям, примеры представителей отдельных классов.
- •11. Иммуноглобулины, классы иммуноглобулинов, особенности доменного строения и функционирования.
- •12. Ферменты, определение. Особенности ферментативного катализа. Специфичность действия ферментов, виды.
- •13.Классификация и номенклатура ферментов, примеры.
- •1. Оксидоредукпшзы
- •2.Трансферты
- •V. Механизм действия ферментов
- •1. Формирование фермент-субстратного комплекса
- •3. Роль активного центра в ферментативном катализе
- •1. Кислотно-основной катализ
- •2. Ковалентный катализ
- •15. Кинетика ферментативных реакций. Зависимость скорости ферментативных реакций от температуры, рН среды, концентрации фермента и субстрата. Уравнение Михаэлиса-Ментен, Кm.
- •16. Кофакторы ферментов: ионы металлов их роль в ферментативном катализе. Коферменты как производные витаминов. Коферментные функции витаминов в6, рр и в2 на примере трансаминаз и дегидрогеназ.
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •1. Механизм "пинг-понг"
- •2. Последовательный механизм
- •17. Ингибирование ферментов: обратимое и необратимое; конкурентное и неконкурентное. Лекарственные препараты как ингибиторы ферментов.
- •1. Конкурентное ингибирование
- •2. Неконкурентное ингибирование
- •1. Специфические и неспецифические ингибиторы
- •2. Необратимые ингибиторы ферментов как лекарственные препараты
- •19. Регуляция каталитической активности ферментов ковалентной модификацией путем фосфорилирования и дефосфорилирования (на примере ферментов синтеза и распада гликогена).
- •20. Ассоциация и диссоциация протомеров на примере протеинкиназы а и ограниченный протеолиз при активации протеолитических ферментов как способы регуляции каталитической активности ферментов.
- •21. Изоферменты, их происхождение, биологическое значение, привести примеры. Определение ферментов и изоферментного спектра плазмы крови с целью диагностики болезней.
- •22. Энзимопатии наследственные (фенилкетонурия) и приобретенные (цинга). Применение ферментов для лечения болезней.
- •23. Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
- •24. Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
- •27. Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
- •27. Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.(пцр)
- •29. Репликация. Принципы репликации днк. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки.
- •30. Элонгация и терминация репликации. Ферменты. Асимметричный синтез днк. Фрагменты Оказаки. Роль днк-лигазы в формировании непрерывной и отстающей цепи.
- •31. Повреждения и репарация днк. Виды повреждений. Способы репарации. Дефекты репарационных систем и наследственные болезни.
- •32. Транскрипция Характеристика компонентов системы синтеза рнк. Структура днк-зависимой рнк-полимеразы: роль субъединиц (α2ββ′δ). Инициация процесса. Элонгация, терминация транскрипции.
- •33. Первичный транскрипт и его процессинг. Рибозимы как пример каталитической активности нуклеиновых кислот. Биороль.
- •35. Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •1. Инициация
- •2. Элонгация
- •3. Терминация
- •36. Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
- •37. Биохимия питания. Основные компоненты пищи человека, их биороль, суточная потребность в них. Незаменимые компоненты пищи.
- •38. Белковое питание. Биологическая ценность белков. Азотистый баланс. Полноценность белкового питания, нормы белка в питании, белковая недостаточность.
- •39. Переваривание белков: протеазы жкт, их активация и специфичность, оптимум рН и результат действия. Образование и роль соляной кислоты в желудке. Защита клеток от действия протеаз.
- •1. Образование и роль соляной кислоты
- •2.Механизм активации пепсина
- •3.Возрастные особенности переваривания белков в желудке
- •1. Активация панкреатических ферментов
- •2. Специфичность действия протеаз
- •41. Витамины. Классификация, номенклатура. Провитамины. Гипо-, гипер- и авитаминозы, причины возникновения. Витаминзависимые и витаминрезистентные состояния.
- •42. Минеральные вещества пищи, макро- и микроэлементы, биологическая роль. Региональные патологии, связанные с недостатком микроэлементов.
- •3. Жидкостностъ мембран
- •1. Структура и свойства липидов мембран
- •45. Механизмы переноса веществ через мембраны: простая диффузия, пассивный симпорт и антипорт, активный транспорт, регулируемые каналы. Мембранные рецепторы.
- •1. Первично-активный транспорт
- •2. Вторично-активный транспорт
- •Мембранные рецепторы
- •46. Эндэргонические и экзэргонические реакции в живой клетке. Макроэргические соединения. Дегидрирование субстратов и окисление водорода как основной источник энергии для синтеза атф.
- •3.Эндергонические и экзергонические реакции
- •4. Сопряжение экзергонических и эндергонических процессов в организме
- •2. Строение атф-синтазы и синтез атф
- •3.Коэффициент окислительного фосфорилирования
- •4.Дыхательный контроль
- •50. Образование активных форм кислорода (синглетный кислород, пероксид водорода, гидроксильный радикал, пероксинитрил). Место образования, схемы реакций, их физиологическая роль.
- •51. . Механизм повреждающего действия активных форм кислорода на клетки (пол, окисление белков и нуклеиновых кислот). Примеры реакций.
- •1) Инициация: образование свободного радикала (l•)
- •2) Развитие цепи:
- •3) Разрушение структуры липидов
- •1. Строение пируватдегидрогеназного комплекса
- •3. Связь окислительного декарбоксилирования пирувата с цпэ
- •53.Цикл лимонной кислоты: последовательность реакций и характеристика ферментов. Роль цикла в метаболизме.
- •1. Последовательность реакций цитратного цикла
- •54. Цикл лимонной кислоты, схема процесса. Связь цикла с целью переноса электронов и протонов. Регуляция цикла лимонной кислоты. Анаболические и анаплеротические функции цитратного цикла.
- •55. Основные углеводы животных, биологическая роль. Углеводы пищи, переваривание углеводов. Всасывание продуктов переваривания.
- •Методы определение глюкозы в крови
- •57. Аэробный гликолиз. Последовательность реакций до образования пирувата (аэробный гликолиз). Физиологическое значение аэробного гликолиза. Использование глюкозы для синтеза жиров.
- •1. Этапы аэробного гликолиза
- •58. Анаэробный гликолиз. Реакция гликолитической оксидоредукции; субстратное фосфорилирование. Распространение и физиологическое значение анаэробного распада глюкозы.
- •1. Реакции анаэробного гликолиза
- •59. Гликоген, биологическое значение. Биосинтез и мобилизация гликогена. Регуляция синтеза и распада гликогена.
- •61. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы.
- •2. Агликогенозы
- •62. Липиды. Общая характеристика. Биологическая роль. Классификация липидов.Высшие жирные кислоты, особенности строения. Полиеновые жирные кислоты. Триацилглицеролы..
- •64. Депонирование и мобилизация жиров в жировой ткани, физиологическая роль этих процессов. Роль инсулина, адреналина и глюкагона в регуляции метаболизма жира.
- •66. Распад жирных кислот в клетке. Активация и перенос жирных кислот в митохондрии. Β-окисление жирных кислот, энергетический эффект.
- •67. Биосинтез жирных кислот. Основные стадии процесса. Регуляция обмена жирных кислот.
- •2. Регуляция синтеза жирных кислот
- •68. Кетоновые тела, биосинтез и использование в качестве источников энергии. Причины развития кетонемии и кетонурии при голодании и сахарном диабете.
- •69. Холестерин. Пути поступления, использования и выведения из организма. Уровень холестерина в сыворотке крови. Биосинтез холестерина, его этапы. Регуляция синтеза.
- •Фонд холестерола в организме, пути его использования и выведения.
- •1. Механизм реакции
- •2. Органоспецифичные аминотрансферазы ант и act
- •3. Биологическое значение трансаминирования
- •4. Диагностическое значение определения аминотрансфераз в клинической практике
- •1. Окислительное дезаминирование
- •74. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
- •3. Неокислительное дезамитровате
- •75. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
- •76. Оринитиновый цикл мочевинообразования. Химизм, место протекания процесса. Энергетический эффект процесса, его регуляция. Количественное определение мочевины сыворотки крови, клиническое значение.
- •2. Образование спермидина и спермина, их биологическая роль
- •78. Обмен фенилаланина и тирозина. Особенности обмена тирозина в разных тканях.
- •79. Эндокринная, паракринная и аутокринная системы межклеточной коммуникации. Роль гормонов в системе регуляции метаболизма. Регуляция синтеза гормонов по принципу обратной связи.
- •80. Классификация гормонов по химическому строению и биологическим функция.
- •1. Классификация гормонов по химическому строению
- •2. Классификация гормонов по биологическим функциям
- •1. Общая характеристика рецепторов
- •2. Регуляция количества и активности рецепторов
- •82. Циклические амф и гмф как вторичные посредники. Активация протеинкиназ и фосфорилирование белков, ответственных за проявление гормонального эффекта.
- •3. Передача сигналов через рецепторы, сопряжённые с ионными каналами
- •85. Гормоны гипоталамуса и передней доли гипофиза, химическая природа и биологическая роль.
- •2. Кортиколиберин
- •3. Гонадолиберин
- •4. Соматолиберин
- •5.Соматостатин
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •86. Регуляция водно-солевого обмена. Строение, механизмдействия и функции альдостерона и вазопрессина. Роль системы ренин-ангиотензин-альдостерон. Предсердный натриуретический фактор.
- •1. Синтез и секреция антидиуретического гормона
- •2. Механизм действия
- •3. Несахарный диабет
- •1. Механизм действия альдостерона
- •2. Роль системы ренин-ангиотензин- альдостерон в регуляции водно-солевого обмена
- •3. Восстановление объёма крови при обезвоживании организма
- •4. Гиперальдостеронтм
- •87. Регуляция обмена ионов кальция и фосфатов. Строение, биосинтез и механизм действия паратгормона, кальцитонина и кальцитриола.Причины и проявления рахита, гипо- и гиперпаратиреоидизма.
- •1. Синтез и секреция птг
- •2. Роль паратгормона в регуляции обмена кальция и фосфатов
- •3. Гиперпаратиреоз
- •4. Гипопаратиреоз
- •1. Строение и синтез кальцитриола
- •2. Механизм действия кальцитриола
- •3. Рахит
- •2. Биологические функции инсулина
- •3. Механизм действия инсулина
- •1. Инсулинзависимый сахарный диабет
- •2. Инсулинонезависимый сахарный диабет
- •1. Симптомы сахарного диабета
- •2. Острые осложнения сахарного диабета. Механизмы развития диабетической комы
- •3. Поздние осложнения сахарного диабета
- •1. Биосинтез йодтиронинов
- •2. Регуляция синтеза и секреции йодтиронинов
- •3. Механизм действия и биологические функции йодтиронинов
- •4. Заболевания щитовидной железы
- •90. Гормоны коры надпочечников (кортикостероиды). Их влияние на метаболизм клетки. Изменения метаболизма при гипо- и гиперфункции коры надпочечников.
- •3. Изменения метаболизма при гипо- и гиперфункции коры надпочечников
- •91. Гормоны мозгового слоя надпочечников. Секреция катехоламинов. Механизм действия и биологические функции катехоламинов. Патология мозгового вещества надпочечников.
- •1. Синтез и секреция катехоламинов
- •2. Механизм действия и биологические функции катехоламинов
- •3. Патология мозгового вещества надпочечников
- •1. Основные ферменты микросомальных электронтранспортных цепей
- •2. Функционирование цитохрома р450
- •3. Свойства системы микросомального окисления
- •93.Распад гема. Схема процесса, место протекания. «Прямой» и «непрямой» билирубин, его обезвреживание в печени.Диагностическое значение определения билирубина в крови и моче.
- •94. . Нарушения катаболизма гема. Желтухи: гемолитическая, желтуха новорожденных, печеночно-клеточная, механическая, наследственная (нарушения синтеза удф-глюкуронилтрансферазы).
- •1. Гемолитическая (надпечёночная) желтуха
- •2. Печёночно-клеточная (печёночная) желтуха
- •3. Механическая, или обтурационная (подпечёночная) желтуха
- •1. Участие трансфераз в реакциях конъюгации
- •2. Роль эпоксидгидролаз в образовании диолов
- •96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
- •98. Белки сыворотки крови, биологическая роль основных фракций белков, значение их определения для диагностики заболеваний. Содержание и функции некоторых белков плазмы крови
- •98. Ферменты плазмы крови, энзимодиагностика. Количественное определение активности аминотрансфераз (АлАт, АсАт).
- •Аминотрансферазы
- •Аланинаминотрансфераза (алат)
- •99. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Особенности биосинтеза и созревания коллагена. Роль аскорбиновой кислоты в созревании коллагена.
- •104. Значение воды для жизнедеятельности организма. Распределение воды в тканях , понятие о внутриклеточной и внеклеточной жидкостях. Водный баланс, регуляция водного обмена.
96. Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
Дыхательный пигмент, содержащийся в эритроцитах, с помощью которого осуществляется транспорт молекулярного кислорода из легких к тканям. Относится к сложным белкам - хромопротеидам. Молекула гемоглобина состоит из двух частей: простетической группы (гема), в состав которой входит атом железа, и белка типа альбуминов - глобина. На долю гема приходится 4 % молекулы гемоглобина, а глобина - 96 %. Гем относится к порфиринам, он содержит 4 пирроловые группы, соединенные в центре атомом железа. При потере железа гем превращается в гематопорфирин. Как в оксигемоглобине, так и в редуцированном гемоглобине железо находится в двухвалентной закисной форме. Трехвалентная (окисная) форма железа, не способная переносить молекулярный кислород, может образовываться при окислении в метгемоглобин. При разрушении эритроцитов (гемоглобина) в конечном счете в печени образуются желчные пигменты - билирубин и биливердин; в течение суток 3,6 г гемоглобина превращается в желчные пигменты. В капиллярах легких гемоглобин (гем) вступает с кислородом в непрочное соединение, образуя оксигемоглобин, а в капиллярах тканей происходит отщепление кислорода и восстановление гемоглобина. Последний вновь легко вступает в соединение с кислородом. Нарушение дыхательной функции крови может наблюдаться при уменьшении количества гемоглобина, эритроцитов в крови (анемии) и изменении качества гемоглобина: образовании карбоксигемоглобина (отравлении окисью углерода), метгемоглобина (отравлении гемолитическими ядами) сульфгемоглобина.
Типы нормального гемоглобина
С помощью физико-химических методов исследования (электрофорез, хроматография) удалось установить неоднородность человеческого гемоглобина, существование различных его типов как в нормальных, так и в патологических условиях. В настоящее время известны три формы нормального гемоглобина:
Примитивный гемоглобин (гемоглобин Р)
Это гемоглобин, который может быть обнаружен у трехсантиметрового зародыша, характеризуется высокой щелочной резистентностью и малой электрофоретической подвижностью. Находится в эритроцитах зародыша до 18 - недельного возраста (в основном между 7 - й и 12 - й неделями), затем сменяется фетальным гемоглобином.
Фетальный гемоглобин (гемоглобин F)
Представляет собой основную массу гемоглобина с 9 - 13 недельного возраста эмбриона. После третьего месяца - основной гемоглобин плода. Затем содержание его постепенно уменьшается за счет образования с 13 - й недели гемоглобина А. К моменту рождения гемоглобина F остается около 20 %, а 80 % приходится на гемоглобин А. К 4 - 5 месяцу жизни гемоглобина F остается всего 1 - 2 %. Существует метод цитологической дифференцировки гемоглобина F путем обработки мазка крови лимоннокислофосфатной буферной смесью с рН = 3,4. В этих условиях эритроциты, содержащие преимущественно гемоглобин А, подвергаются гемолизу и представляются на препарате в виде теней (стром). Эритроциты, в которых преобладает гемоглобин F, оказываются резистентными и контрастно окрашиваются.
Гемоглобин взрослых (гемоглобин А)
Представляет основную массу гемоглобина взрослых людей. С помощью электрофореза на крахмале установлено наличие нескольких фракций гемоглобина А:
гемоглобин A1 (основная фракция, на долю которой приходится 96 - 98 % всей массы гемоглобина).
гемоглобин A2 (2 - 5 %).
гемоглобин A3 (содержание менее 1 %).
Содержание гемоглобина F в крови взрослого человека составляет 1 - 2 %. Повышение этих величин возможно в условиях патологии. Преобладание того или иного типа гемоглобина совпадает во времени с периодами эмбрионального кроветворения: гемоглобин Р характерен для периода желточного кроветворения, гемоглобин F - для печеночного, гемоглобин А - для периода костномозгового кроветворения.
Аномальные гемоглобины
Наличие в эритроцитах людей аномальных или патологических гемоглобинов определяет состояния, обозначаемые как гемоглобинозы, или гемоглобинопатии. Это наследственные аномалии кроветворения, при которых молекулы патологических гемоглобинов имеют измененную структуру, поэтому подобные заболевания относятся к группе так называемых молекулярных болезней. Аномальные гемоглобины различаются своими физико - химическими свойствами (электрофоретической подвижностью, резистентностью к щелочам, растворимостью, изоэлектрической точкой), а также по молекулярной структуре глобиновой части (по одному из пептидов, в котором изменена последовательность аминокислот). Появление аномальных гемоглобинов объясняется мутационной теорией, передача потомкам аномального гена осуществляется по законам наследственности. У гетерозиготных особей (Аа) заболевание отсутствует или обнаруживаются субклинические признаки, у гомозиготных (от брака гетерозиготных особей) наблюдается развитие тяжелых анемий гемолитического типа. В настоящее время установлено более 200 аномальных гемоглобинов: B (S), С, D, Е, G, J, I, К, L, M, N, О, Р, Q и других, а также возможные их комбинации (SC, SD и др.). На XVI Международном конгрессе гематологов (Япония, 1976 г.) сделаны сообщения о новых аномальных гемоглобинах: Hb Beth (Nagel, США), Hb Austin (Moo-Peen, США), Hb Djelfa (Labie, Франция), Hb Hrosaki (Ohba, Япония), Hb Waco (Moo-Peen, США). Гемоглобинозы в гетерозиготной и гомозиготной форме имеют распространение в экваториальной Африке, странах, омываемых Средиземным морем, на Аравийском полуострове, в Южной Индии, на острове Шри-Ланка, в Юго-Восточной Азии, Южном Китае, южных районах США. Причину появления аномальных гемоглобинов объясняет малярийная гипотеза, согласно которой мутации в гене, контролирующем образование гемоглобина, возникли в странах с широким распространением тропической малярии. Было установлено, что наличие аномального гена в гетерозиготной форме повышает устойчивость людей к заболеванию, создает иммунитет к малярии, так как изменения молекулы гемоглобина препятствуют использованию его малярийным плазмодием.
Гемоглобин S
Отличается от гемоглобина А строением четвертого пептида, в котором на шестом месте вместо глутаминовой кислоты находится электрически нейтральный валин. Гемоглобин S менее растворим, нейтрален по заряду, электрофоретически менее подвижен. В капиллярах при отдаче кислорода гемоглобин S выпадает в осадок в форме веретенообразных кристаллоидов (тактоидов), которые растягивают оболочку и ведут к распаду эритроцитов. У гетерозиготов содержание гемоглобина S равняется 20 - 45 %, у гомозиготов - 60 - 90 %. Гетерозиготная форма аномалии протекает бессимптомно или сопровождается легкой гемолитической анемией. У гомозиготных особей уже с первых месяцев жизни развивается тяжелая форма серповидноклеточной анемии.
Гемоглобин F
Характерный для крови плода фетальный гемоглобин может быть обнаружен в повышенных количествах в эритроцитах крови недоношенных детей, при коклюше, серповидноклеточной анемии, талассемии, врожденной микроцитарной анемии, пернициозной анемии, острых и хронических лейкозах, миеломной болезни. Наибольшее содержание (до 97 %) наблюдается при большой талассемии.
Гемоглобин С
Отличается строением четвертого пептида молекулы гемоглобина, в котором на шестом месте вместо глутаминовой кислоты находится лизин. Центр распространения гена С - северная часть Ганы. Частота гетерозиготности по данным одних авторов, до 15 %, по данным других, - 16,5 - 28 %, среди негров США - 1,8 - 3% на Ямайке - 2,7 % (В. П. Эфроимсон). Наличие гена С в гомозиготном состоянии ведет к развитию выраженной спленомегалии, умеренной микроцитарной анемии с наличием эритроцитов мишеневидной формы. При наличии комбинации гемоглобинов С и S анемия оказывается более тяжелой.
Гемоглобин D
Обнаружен у 2 % берберов Марокко и у 0,4 % негров США. У гомозиготов наблюдается микроцитоз, слабый анизо- и пойкилоцитоз и мишеневидность эритроцитов. Описано несколько гемоглобинов D (в северо-западной Индии, среди сикхов в Индии, на острове Кипр, в Турции).
Гемоглобин Е
Обнаружен у жителей Юго-Восточной Азии: в Кампучии, Таиланде, Бирме, Бенгалии, у веддов Шри-Ланки, в северо-восточной Малайе, у населения Калимантана и Сулавеси. Частота распространения гена С в разных местностях колеблется от 1 - 3 до 13 (Таиланд) - 20 (Бирма) - 28 - 37 % (Кампучия). У гомозиготов ЕЕ наблюдается микроцитоз, компенсируемый развитием эритроцитоза (до 7 - 8 x 1012 /л). Отмечены комбинации генов ES и ЕТ, дающие сублетальный эффект. Клинические проявления при других гемоглобинозах выражены слабо, а распространение более ограниченное (гены G, I, J, К, L, M, N, О, Р, Q).
Гемоглобинопатии
Серповидноклеточная анемия - тяжёлое наследственное заболевание, обусловленное точечной мутацией гена, кодирующего структуру β-цепи гемоглобина (см. раздел 4). В результате в эритроцитах больных присутствует HbS, β-цепи которого в шестом положении вместо гидрофильной глутаминовой кислоты содержат гидрофобную аминокислоту валин. Появление гидрофобной аминокислоты недалеко от начала молекулы способствует возникновению нового центра связывания, поэтому при низком парциальном давлении кислорода тетрамеры дезокси-HbS ассоциируют, образуя длинные микротрубчатые образования, которые полимеризуются внутри эритроцитов. Полимеризация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются. При этом заболевании отмечают анемию, прогрессирующую слабость, отставание в развитии и желтуху.
Носители гена серповидноклеточной анемии чаще всего встречаются среди африканского населения, так как они приобретают некоторое преимущество при заболевании малярией, часто встречающейся в странах с тропическим климатом. Причина сохранения гена серповидноклеточной анемии в популяции связана с тем, что в эритроцитах гетерозигот хуже развивается малярийный плазмодий, часть жизненного цикла которого проходит в эритроцитах человека. В связи с этим гетерозиготные носители дефектного
гена выживали при эпидемиях малярии, однако четверть их потомства погибала от серповиднок-леточной анемии.
Талассемии - наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям. Нарушение эритропоэза и ускоренный гемолиз эритроцитов и клеток-предшественников при талассемиях приводит к анемии.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи. При этом заболевании в костном мозге из-за преципитации нестабильных α-цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина р-цепи не требуются (см. раздел 4), поэтому клинически β-талассемия не проявляется до рождения, после чего происходит переключение синтеза HbF на НBА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии. При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или НBН, который, подобно гемоглобину Барта, имеет слишком высокое сродство к кислороду, менее стабилен, чем НBА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Наследственный сфероцитоз. Причиной этой патологии чаще всего является дефект белков цитоскелета эритроцитов - спектрина или ан-кирина, которые обеспечивают поддержание двояковогнутой формы клетки и эластичности мембраны. Эритроциты приобретают шарообразную форму, что приводит к уменьшению площади их поверхности и снижению скорости газообмена. Потеря эластичности клеточной мембраны приводит к повышению хрупкости и травматичности клеток и, как следствие, к ускорению их разрушения в сосудистом русле и селезёнке. Заболевание сопровождается анемией и желтухой. Удаление селезёнки (спленэктомия) при наследственном сфероцитозе улучшает состояние больных, так как предотвращает разрушение сфероцитов в селезёнке.
Мегалобластная (макроцитарная) анемия развивается при дефиците фолиевой кислоты или витамина В12.
Фолиевая кислота в виде кофермента (Н4-фолата) участвует в синтезе нуклеотидов. Недостаток фолиевой кислоты приводит к снижению скорости синтеза ДНК в быстроделящихся клетках, и в первую очередь в предшественниках эритроцитов. Клетки дольше пребывают в интерфазе, синтезируя гемоглобин, и становятся крупнее. Кроме того, из-за недостатка нуклеотидов они реже делятся, и количество эритроцитов снижается, а крупные мегалобласты быстрее разрушаются. Всё это в конечном итоге приводит к развитию анемии.
Аналогичная симптоматика развивается при недостатке в организме витамина В12. Этот витамин участвует в переносе метальной группы с N5-метил-Н4-фолата на гомоцистеин с образованием метионина и Н4-фолата (см. раздел 10). Недостаточность витамина В12 приводит к накоплению N5-метил-Н4-фолата в клетках. Дефицит Н4-фолата приводит к нарушению деления клеток и развитию анемии.
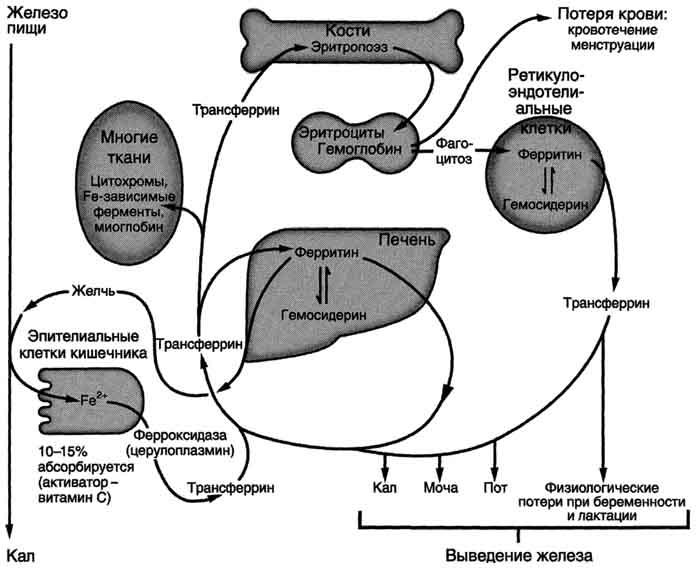
97. Биосинтез гема. Схема процесса, химизм первых двух реакций, место протекания. Регуляция активности ферментов АЛК-синтазы и АЛК-дегидратазы. Источники железа для синтеза гема, всасывание железа, транспорт в крови, депонирование.
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и печени (рис. 13-2). В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450.
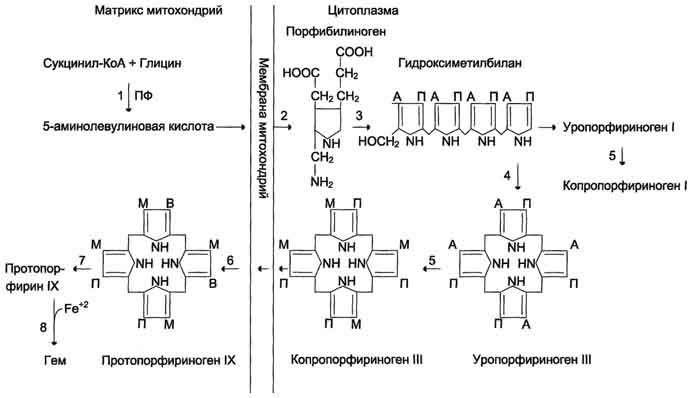
Рис. 13-2. Синтез гема. Цифрами на схеме указаны ферменты: 1 - аминолевулинатсинтаза; 2 - аминолевулинатдегидратаза; 3 - порфобилиногендезаминаза; 4 - уропорфириноген III косинтаза; 5 - уропорфириногендекарбоксилаза; 6 - копропорфи-риноген III оксидаза; 7 - протопорфириногеноксидаза; 8 - феррохелатаза. Буквами обозначены заместители в пиррольных кольцах: М - метил, В - винил, П - остатки пропионовой кислоты, А - ацетил, ПФ - пиридоксальфосфат. Донором железа служит депонирующий железо в клетках белок ферритин.
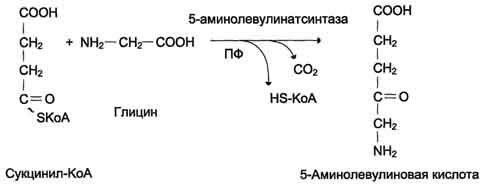
Рис. 13-3. Реакция образования 5-аминолевулиновой кислоты.
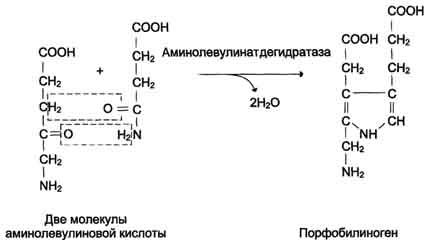
Реакция образования порфобилиногена.
В. Регуляция биосинтеза гема
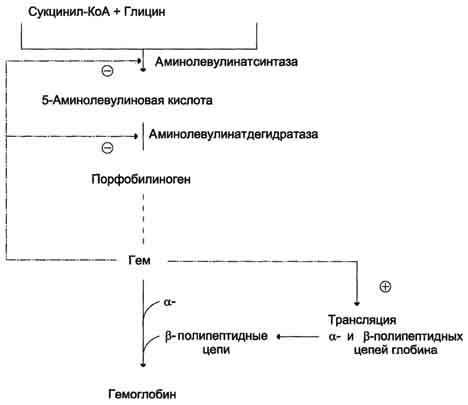
Регуляция синтеза гема и гемоглобина. Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина.
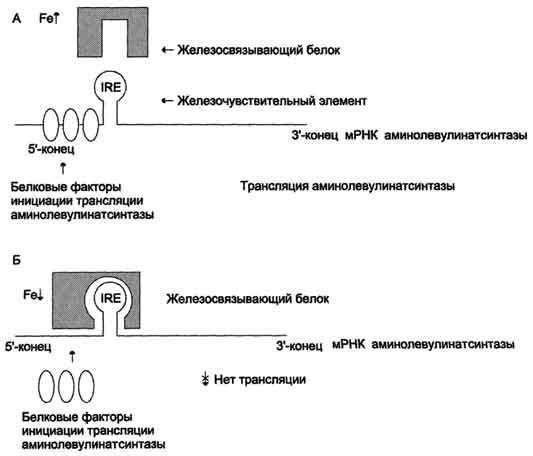
Регуляция синтеза аминолевулинатсинтазы. А - при высокой концентрации железа в ретикулоцитах оно присоединяется к железосвязывающему белку и снижает сродство этого белка к железочувствительному элементу (IRE) матричной РНК, кодирующей аминолевулинатсинтазу. Белковые факторы инициации трансляции связываются с мРНК и инициируют трансляцию аминолевулинатсинтазы. Б - при низком содержании железа в ретикулоцитах железосвязывающий белок обладает высоким сродством к IRE и взаимодействует с ним. Белковые факторы инициации трансляции не могут присоединиться к мРНК, и трансляция прекращается.
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.