
- •Основы химической термодинамики
- •Некоторые основные термины и определения
- •Понятие о функции состояния
- •Внутренняя энергия, теплота, работа
- •Первый закон термодинамики. Понятие об энтальпии
- •Тепловой эффект химической реакции
- •Термохимические расчеты
- •Понятие об энтропии и второй закон термодинамики
- •Число микросостояний (термодинамическая вероятность) и энтропия
- •Свойства энтропии Зависимость энтропии от объема
- •Зависимость энтропии от давления
- •Зависимость энтропии от температуры
- •Энергия Гиббса и состояние химического равновесия
- •Химическое равновесие
- •Вопросы для подготовки к семинару и экзамену
- •Примеры решения задач
- •2 Моля so3 - 198 кДж
- •Задачи для домашних заданий
- •Варианты домашних заданий
- •Задача повышенной трудности.
- •Приложение
- •Фундаментальные физические константы
- •Нуль шкалы Цельсия То 273,15 к
Химическое равновесие
Рассмотрим
как меняется энергия Гиббса веществ
при равновесии химической реакции:
аА(Г)
![]() bВ(Г).
bВ(Г).
Очевидно, что по мере расходования вещества А его энергия Гиббса будет уменьшаться, а энергия Гиббса конечного продукта будет возрастать. При достижении равновесия энергия Гиббса реакции станет равной нулю:
Gреакции
=
![]() G
продуктов реакции
-
G
продуктов реакции
-
![]() G
исходных веществ
= 0.
G
исходных веществ
= 0.
Для рассматриваемой реакции:
Gреакции = b GB - а GА = 0
или аGА = bGB (24)
При равенстве энергий Гиббса продуктов реакции и исходных веществ движущая сила реакции исчерпана, и реакция останавливается, т.е. парциальные давления всех веществ становятся постоянными и не меняются как угодно долго (при данных условиях). Такое состояние химической системы называется состоянием химического равновесия. Установившиеся при этом парциальные давления веществ называются равновесными.
Запишем условие равновесия с учетом уравнений (20) и (24):
![]() .
.
Для нашего случая:
![]()
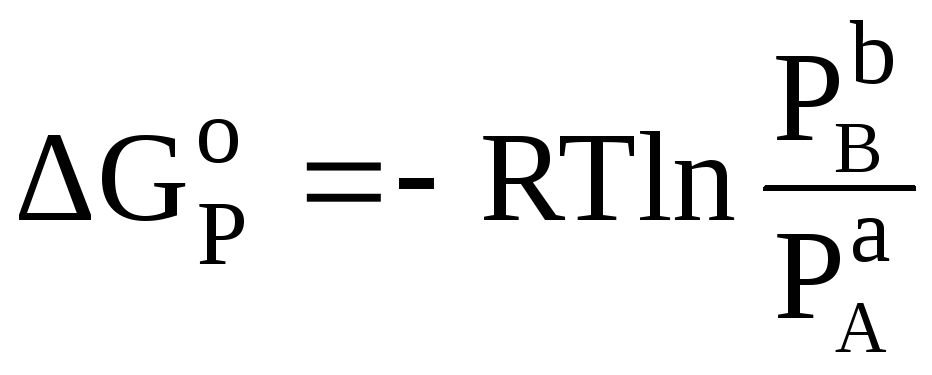 .
.
Размерность
![]() - Дж или кДж.
- Дж или кДж.
Соотношение
равновесных парциальных давлений
![]() - величина для данных условий постоянная
и называетсяконстантой
равновесия
(Кр):
- величина для данных условий постоянная
и называетсяконстантой
равновесия
(Кр):
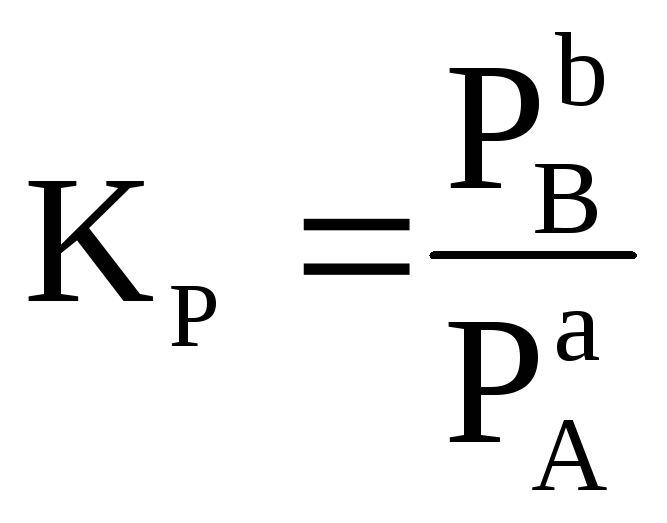 .
.
Следовательно, можно записать, что:
![]() .
(25)
.
(25)
Константа равновесия равна отношению произведения равновесных парциальных давлений продуктов реакции и исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам веществ в рассматриваемой реакции.
Например, для реакции N2(Г) + 3H2(Г) « 2 H3(Г) константа равновесия запишется как
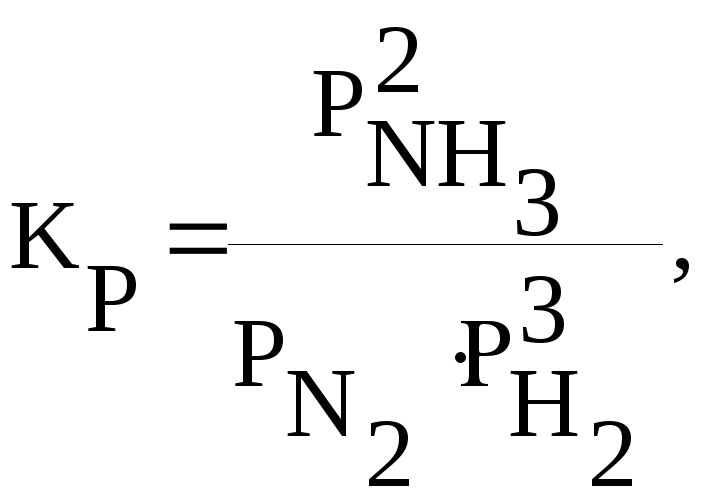
где р – равновесные относительные парциальные давления соответствующих веществ.
|
Константу равновесия можно рассчитать, объединяя уравнения (23) и (25):
При перегруппировке членов этого уравнения получим уравнение: |
|
|
Из уравнения (26) видно, что КР для данной системы зависит только от температуры. При данной температуре это величина постоянная и не зависит от первоначальных количеств взятых для реакции веществ. |
|
|
При использовании молярных концентраций веществ, участвующих в реакции, равновесие характеризуется концентрационной константой равновесия (КС), которая равна отношению произведений равновесных концентраций продуктов реакции и исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам веществ в рассматриваемой реакции. Для
реакции аA
где
Рассмотрим взаимосвязь констант равновесия, выраженных через парциальные давления и концентрации. Если в объеме V находится nA молей вещества А и nB молей вещества В, то парциальные давления этих веществ будут равны соответственно:
а равновесные концентрации:
Исходя из уравнения состояния для идеального газа
получим:
Тогда
|
|
|
Если все реагенты газообразны и их поведение подчиняется закону идеальных газов, то связь между КР и КС можно выразить уравнением: | |
|
|
|
КР = КС (RT) ∆v , (27)
где R – газовая постоянная, равная 0,082 латм/мольК,
если давление выражено в атмосферах, а концентрация
в моль/л;
∆![]() –изменение
числа молей газов в результате реакции:
∆
–изменение
числа молей газов в результате реакции:
∆![]() = (b
– а) - для приведенной выше реакции.
= (b
– а) - для приведенной выше реакции.
Например, для реакции синтеза аммиака N2(Г) + 3H2(Г) «2 NH3(Г)
∆![]() =
2 – (1 + 3) = - 2 и КС
= КР(RT)
2.
=
2 – (1 + 3) = - 2 и КС
= КР(RT)
2.
Например, для рассмотренной выше реакции константа равновесия запишется как
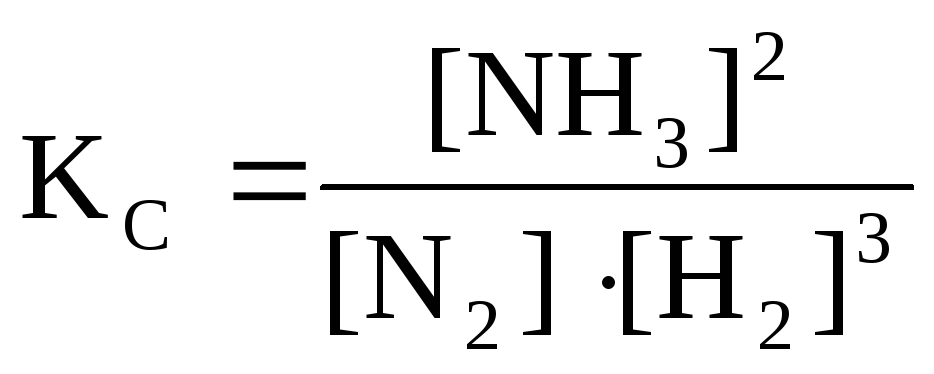 ,
,
где
![]()
![]()
![]() - равновесные
концентрации веществ, участвующих в
реакции в моль/л.
- равновесные
концентрации веществ, участвующих в
реакции в моль/л.
Если реакция идет без изменения объема (количества молей газообразных веществ в результате реакции не меняется), или реакция протекает в растворе, то КР = КС.
Например, для реакции N2(Г) + O2(Г) « 2 NO(Г), КР = КС.
Парциальные давления (концентрации) твердых веществ, принимающих участие в реакции, в выражение константы равновесия не включаются. Например, для реакции
MgCO3(тв)
![]() MgO(тв)
+ CO2(Г),
MgO(тв)
+ CO2(Г),
КР
=
![]() ,
KС
= [CO2]равн.
,
KС
= [CO2]равн.
Л И Т Е Р А Т У Р А
1. Глинка, Н.Л. Общая химия: учеб. / Н.Л. Глинка. – М.: КноРус, 2012.
2. Коровин, Н.В. Общая химия: учеб. / Н.В. Коровин. – изд. Академия, 2011, серия: Высшее профессиональное образование.

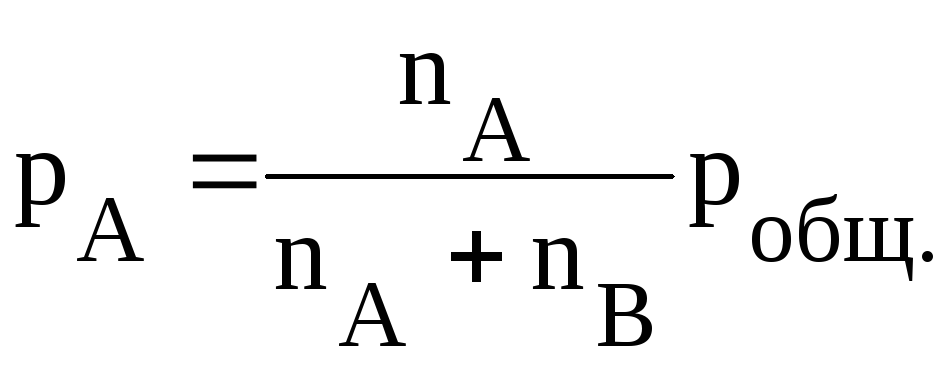 и
и
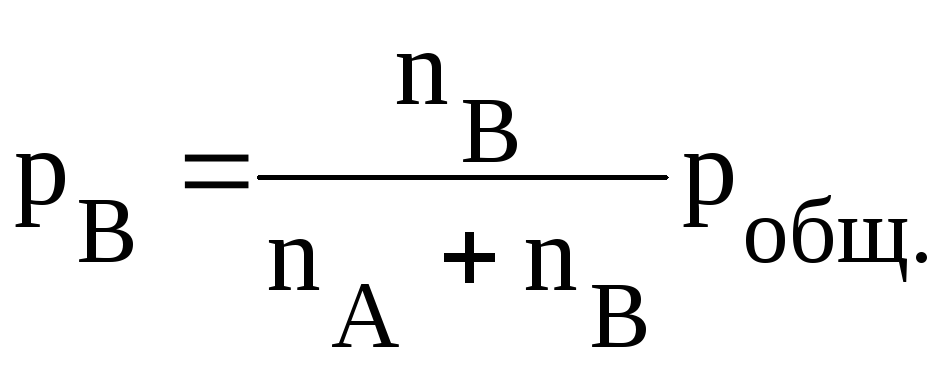 ,
,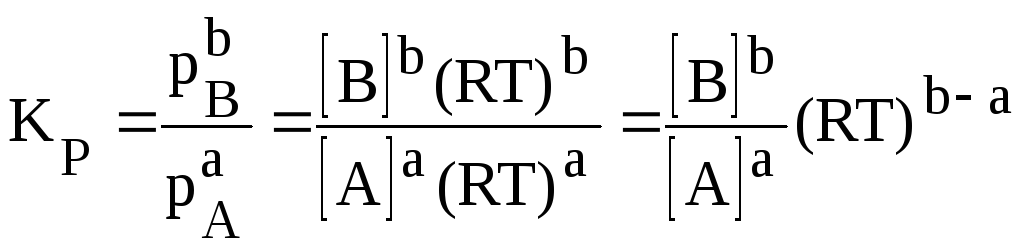 .
.