
- •Вопросы по химии к модулю №3
- •Теория кислот и оснований Бренстеда (протолитическая теория). Равновесия в сопряженной кислотно-основной паре.
- •Теории кислот и оснований: теория электролитической диссоциации Аррениуса: понятия “электролитическая диссоциация”, “электролит”. “ион”, “катион”, “анион”.
- •Ступенчатый характер диссоциации слабых электролитов. Закон разбавления Оствальда (формулировка и математическое выражение).
- •Константа диссоциации слабых кислот и оснований (константа кислотности Ка, константа основности Кb) как константа равновесия процесса диссоциации. Показатель константы диссоциации (рКа и рКb).
- •Ионное произведение воды. Водородный показатель. РН и рОн растворов. Расчёт рН в растворах сильных и слабых электролитов.
- •Гидролиз солей. Биологическое значение.
- •Теория строения комплексных соединений (теория Вернера): внутренняя и внешняя сфера, комплексообразователь, лиганды, координационное число, дентантность.
- •Комплексообразующая способность s-р-и d- элементов. Её причины.
- •Классификация комплексных соединений по заряду внутренней сферы и характеру лиганда.
- •Номенклатура комплексных соединений.
- •Диссоциация комплексных соединений в растворе, константы нестойкости и стойкости комплексных соединений.
- •Биологическая роль комплексных соединений в организме.
- •Металло-лигандный гомеостаз и причины его нарушения.
- •Роль биогенных элементов в организме: классификации, топография химических элементов, содержащихся в организме человека. Биологическая роль макро- и микроэлементов.
Ступенчатый характер диссоциации слабых электролитов. Закон разбавления Оствальда (формулировка и математическое выражение).
Диссоциация слабых электролитов – процесс обратимый. В их растворах имеет место химическое равновесие
![]()
![]() CН3СООН
СН3СОО- + Н+
CН3СООН
СН3СОО- + Н+
![]()
![]() NH4OH
NH4+ + OH-
NH4OH
NH4+ + OH-
Используя закон действующих масс, равновесие можно выразить величиной константы диссоциации (ионизации).
![]()
![]()
![]()
Эти величины очень малы, поэтому вместо констант принято использовать показатели этих величин pKa = - lgKa ; pKв = - lgKв
Чем меньше рК, тем больше это вещество распадается на ионы.
Многоосновные кислоты и многокислотные основания ионизируют ступенчато. Каждая ступень ионизации характеризуется своим значением константы ионизации, причем первая ступень протекает в большей степени, чем последующие.
Способность к ступенчатой ионизации определяет способность кислот и оснований к образованию кислых и основных солей.
Многоосновные кислоты и основания диссоциируют ступенчато. Например
Н3РО4 = Н+ + Н2РО4‾
Н2РО4‾ = Н+ + НРО4‾2
![]() НРО4‾2 =
H+ + РО4 ‾3
НРО4‾2 =
H+ + РО4 ‾3
Н3РО4 = 3Н+ + РО4-3
Диссоциация характеризуется константами для каждой стадии
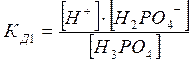
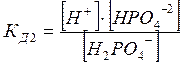
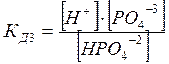
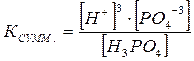
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
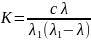
Здесь K — константа диссоциации электролита, c — концентрация, λ и λ1 — значения эквивалентной электропроводности при концентрации c и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства
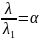
где α — степень диссоциации.
Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации.
Константа диссоциации слабых кислот и оснований (константа кислотности Ка, константа основности Кb) как константа равновесия процесса диссоциации. Показатель константы диссоциации (рКа и рКb).
Кд – константа диссоциации – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Например, КА K++AК
Кд показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше Кд, тем сильнее электролит. Кд зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Константа кислотной диссоциации (константа кислотности) Ка равна:
Ка=[Н+]∙ [А-]/[НА]
В растворе слабых оснований В кислотно-основное равновесие имеет вид
В+ Н2О ВН++ОН
где В-основание, а ВН+ - сопряженная В кислота. Константа кислотно-основного равновесия в этом случае в соответствии с законом действующих масс равна:
Кb=[BН+]∙ [ОН-]/[В]
Константу Кb называют константой диссоциации основания В или константой основности.
Величины Ка и Кb для сопряженной кислотно-основной пары связаны также простым соотношением.
Ка Кb=10-14 или рКа+рКb=14, рКb=14-рКа
Таким образом, сила кислот и оснований может быть выражена в общей шкале рКа, подобно тому, как реакция среды характеризуется водородным показателем рН.
