
- •2. Вещество
- •2.1. Виды химической связи: атомная (ковалентная), ионная, металлическая, водородная
- •1) Алканов; 2) альдегидов; 3) спиртов; 4) алкинов.
- •2.2. Способы образования ковалентной связи. Длина и энергия связи. Образование ионной связи
- •2.3. Понятие об электроотрицательности химических элементов. Заряды ионов и степени окисления химических элементов в соединениях
- •2.4. Вещества молекулярного и немолекулярного строения. Типы кристаллических решеток. Зависимость свойств веществ от особенностей их кристаллической решетки
- •1) Алмаз; 2) известняк; 3) кварц; 4) сахароза.
- •1) Фторид натрия; 2) вода; 3) серебро; 4) бром.
- •1) Атомная; 2) молекулярная; 3) ионная; 4) металлическая.
- •2.6. Основные положения и направления развития теории химического строения органических веществ а. М. Бутлерова. Изомерия и гомология органических веществ
- •2.7. Гомологи и изомеры углеводородов
- •Структурная изомерия.
- •Пространственная изомерия.
- •2.9. Общая характеристика металлов главных подгрупп I–III групп в связи с их положением в периодической системе химических элементов д. И. Менделеева и особенностями строения их атомов
- •2.10. Медь, хром, железо – металлы побочных подгрупп
- •1) Оксид хрома (II) 2) оксид хрома (III) 3) оксид хрома (VI) 4) хром
- •2.11. Общая характеристика неметаллов ivа–viiа групп в связи с их положением в периодической системе химических элементов д. И. Менделеева и особенностями строения их атомов
- •1) Железо 2) хром 3) медь 4) цинк
- •2.12. Характерные химические свойства неорганических веществ различных классов: оксидов (основных, амфотерных, кислотных), оснований, амфотерных гидроксидов, кислот, солей
- •1. Оксиды
- •1) Кислотами 2) водой 3) водородом 4)кислотными оксидами.
- •1) Металлами 3) солями 2) оксидами металлов 4) щелочами.
- •2.13. Взаимосвязь неорганических веществ
- •2.15. Виды гибридизации электронных облаков
2.10. Медь, хром, железо – металлы побочных подгрупп
Железо
Строение атома и положение в периодической системе. Заряд ядра атома железа +26, в ядре 26 р и 30 n, а в электронной оболочке – 26 е. Аr(Fe) = 56. 26 е располагаются на 4-х энергетических уровнях (на это указывает номер периода). Символ элемента находится в побочной подгруппе, т. к. Fe – элемент d-семейства (у его атомов заполняется электронами d-подуровень предвнешнего уровня, а на внешнем уровне – 2 е). Электронная формула атома Fe: 1s22s22p63s23p63d64s2. Распределение электронов по энергетическим уровням и подуровням в атоме железа говорит о том, что этот элемент проявляет переменную валентность. Рассмотрим валентные возможности атома железа:
4s 3d 3р 3s Электронная структура атома железа, невозбужденное состояние, валентность = 0 |
4р 4s 3d 3р 3s Второе валентное состояние атома (возбужденное), может проявлять валентности II (за счет 4s14р1 электронов) и VI (3d44s14р1) |
4р 4s 3d 3р 3s Третье валентное состояние атома (возбужденное), может проявлять валентности III (за счет 4s14р2 электронов) и VIII (3d54s14р2) |
Наиболее характерны для железа валентности II и III, менее характерны валентности VI и VIII.
Распространенность в природе. Железо – четвертый по распространенности в земной коре элемент (после О, Si и Al) и наиболее распространенный из тяжелых металлов. В природе химический элемент железо находится в связанном виде: входит в состав горных пород, природных вод, содержится в живых организмах. Важнейшие руды железа – магнетит (магнитный железняк) Fe3O4 (FeIIFe2IIIO4), гематит (красный железняк) Fе2О3, лимонит (бурый железняк) Fе2О3nН2О, сидерит (шпатовый железняк) FеСО3, пирит (железный или серный колчедан) FеS2.
Характеристика простого вещества. Как любой металл, железо имеет металлическую кристаллическую решетку, поэтому обладает общими свойствами металлов.
Железо – серебристо-белый, пластичный, относительно мягкий, достаточно тяжелый металл. Легко подвергается ковке, прокатке и другим видам обработки. Проявляет магнитные свойства: притягивается магнитом и само намагничивается и размагничивается (ферромагнетик).
В химическом отношении железо весьма активно. Оно взаимодействует с простыми веществами:
– с галогенами при нагревании. Железная проволока, нагретая до красного каления, горит в атмосфере хлора: 2Fе + 3Сl2 = 2FеСl3.
Аналогично протекают реакции с другими галогенами, но при переходе Cl2 Br2 I2 – все менее бурно. В случае реакции с I2 образуется FeI2.
– с кислородом. При обычной температуре оно очень медленно окисляется кислородом воздуха, однако накаленное железо легко сгорает с образованием оксида железа (II, III), или железной окалины: 3Fе + 2О2 = Fе3О4.
В присутствии влаги окисление железа на воздухе происходит быстрее, и оно ржавеет, т.е. покрывается слоем гидратированного железа (III): 4Fе + 3О2 + nН2О 2Fе2О3nН2О.
Образующийся слой ржавчины – хрупкий и рыхлый, пористый, поэтому не предохраняет металл от дальнейшей коррозии.
– с серой: Fe + S FeS + Q
Если смесь порошков Fe и S локально нагреть (для инициации реакции), то реакция распространяется на весь объем смеси и поддерживается за счет выделяющегося тепла.
– с углеродом при нагревании: 3Fe + C Fe3С (карбид железа, или цементит).
Железо взаимодействует и со сложными веществами.
Железо сравнительно легко реагирует с растворами кислот, не проявляющих окислительных свойств аниона, с выделением Н2 и образованием Fе2+:
Fе + 2НСl FеСl2 + Н2, Fе + 2Н+ Fе2+ + Н2.
Разбавленная HNO3 окисляет железо до степени окисления +3:
Fe + 4HNO3(разб.) Fe(NO3)3 + NO + 2H2O, Fe + 4H+ + NO3– Fe3+ + NO + 2H2O.
Под действием концентрированных H2SO4 и HNO3 при комнатной температуре железо пассивируется: на его поверхности образуется прочная оксидная пленка, препятствующая дальнейшему взаимодействию. Это позволяет использовать стальные цистерны для транспортировки концентрированной H2SO4. Однако при нагревании железо реагирует с этими кислотами:
2Fе
+ 6Н2SО4(конц.)
![]() Fе2(SО4)3
+ 3SО2 + 6Н2О,
2Fе + 12Н+ + SО42-
= 2Fе3+ + 3SО2
+ 6Н2О;
Fе2(SО4)3
+ 3SО2 + 6Н2О,
2Fе + 12Н+ + SО42-
= 2Fе3+ + 3SО2
+ 6Н2О;
Fе + 6НNО3(конц.) Fе(NО3)3 + 3NО2 + 3Н2О, Fе + 6Н+ + 3NО3- = Fе3+ + 3NО2 + 3Н2О.
Щелочи не действуют на железо.
Железо реагирует с растворами солей металлов, расположенных в ряду стандартных электродных потенциалов правее: Fe + CuSO4 FeSO4 + Cu.
При высоких температурах железо реагирует с CО2 и Н2О:
Fe + CO2 ⇄ FeO + CO; 3Fe + 4H2O(г) ⇄ Fe3O4 + 4H2.
Соединения железа. Железо обладает небольшой электроотрицательностью, поэтому в соединениях оно проявляет положительные степени окисления. В зависимости от проявления степеней окисления для железа наиболее характерны четыре ряда соединений – соединения железа II, III, VI и VIII. Наиболее устойчивыми являются соединения железа (III). Соединения шестивалентного железа неустойчивы и встречаются крайне редко, это например, ферраты калия и бария К2FeО4 и ВаFeО4. Соединения железа (VIII) не получены.
Соединения железа (II). Оксид железа (II) FeO – твердое вещество черного цвета, нерастворимое в воде, получается при термическом разложении карбоната или гидроксида железа (II) без доступа воздуха: FeCO3 FeO + CO2; Fe(OH)2 FeO + Н2О.
FeO – основной оксид, взаимодействует с кислотами. При высоких температурах он окисляется кислородом: 4FeO + O2 2Fe2O3, или 6FeO + O2 2Fe3O4.
Водород и СО восстанавливают FeO при высоких температурах:
FeO + H2 ⇄ Fe + H2O; FeO + CO ⇄ Fe + CO2.
Гидроксид железа (II) получают в виде студенистого светло-зеленого осадка при действии щелочей на растворы солей железа (II): FeCl2 + 2NaOH Fe(OH)2 + 2 NaCl.
Fe(OH)2 – основной оксид, взаимодействует с кислотами. На воздухе он легко окисляется:
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3.
При этом цвет осадка становится все более темным серо-зеленым, а при полном окислении – коричневым.
Соли железа (II) также легко окисляются:
6FeSO4 + 3NaClO + 3H2O 2Fe2(SO4)3 + 2Fe(OH)3 + 3NaCl;
4FeSO4 + O2 + 2H2O 4(FeOH)2SO4.
Так как Fe(ОН)2 – основание средней силы, соли железа (II) в водных растворах слабо гидролизованы.
Соединения железа (III). Оксид железа (III) Fe2O3 – твердое вещество красно-бурого цвета, нерастворимое в воде. Получают его либо термическим разложением гидроксида железа (III), либо окислением тонкого порошка металлического железа:
2Fe(OH)3 Fe2O3 + 3H2O; 4Fe + 3O2 2Fe2O3.
Fe2O3 проявляет слабые амфотерные свойства с преобладанием основных:
Fe2O3
+ 6HCl
2FeCl3
+ 3H2O; Fe2O3
+ 2NaOH
![]() 2NaFeO2
+ H2O.
2NaFeO2
+ H2O.
феррит натрия
Fe2О3 является окислителем средней силы:
2Al
+ Fe2O3
![]() 2Fe + Al2O3; Fe2O3
+ CO
2FeO + CO2.
2Fe + Al2O3; Fe2O3
+ CO
2FeO + CO2.
Гидроксид железа (III) получают в виде бурого студенистого осадка действием щелочей на растворы солей железа (III): FeCl3 + 3NaOH Fe(OH)3 + 3NaCl.
Fe(ОН)3 проявляет амфотерные свойства (с преобладанием основных):
Fe(OH)3 + 3HCl FeCl3 + 3H2O; Fe(OH)3 + 3KOH(конц.) K3[Fe(OH)6]
гексагидроксоферрат(III) калия
Fe(OH)3 – более слабый электролит, чем Fe(OH)2, поэтому соли железа (III) сильно гидролизуются, а со слабыми кислотами Fe(OH)3 солей не образует. Гидролизом объясняется и цвет растворов солей железа (III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в желто-бурый цвет, что объясняется присутствием гидроксоионов железа:
Fe3+ + H2O ⇄ FeOH2+ + H+; FeOH2+ + H2O ⇄ Fe(OH)2+ + H+;
Fe(OH)2+ + H2O ⇄ Fe(OH)3 + H+.
Соли железа (III) проявляют окислительные свойства:
Mg + 2FeCl3 MgCl2 + 2FeCl2; 2FeCl3 + 6KI 2FeI2 + I2 + 6KCl.
Двойной оксид железа Fe3O4 – твердое вещество черного цвета с ферромагнитными свойствами, нерастворимое в воде. Он может быть получен окислением металла кислородом воздуха или парами воды при высокой температуре:
3Fe + 2O2 Fe3O4; 3Fe + 4H2O Fe3O4 + 4H2.
Этот оксид реагирует с кислотами, образуя одновременно соли железа (II) и (III):
Fe3O4 + 8HCl 2FeCl3 + FeCl2 + 4H2O.
Соединения железа (VI). Если нагревать стальные опилки или оксид железа (III) с нитратом и гидроксидом калия, то образуется сплав, содержащий феррат калия – соль железной кислоты: Fe2O3 + 4KOH + 3KNO3 2K2FeO4 + 3KNO2 + 2H2O.
Ферраты – кристаллические вещества, обычно красного цвета. Все ферраты – очень сильные окислители: 2K2FeO4 + 2NH3H2O 2Fe(OH)3 + N2 + 4KOH.
Ферраты термически неустойчивы. При нагревании малиново-красного раствора K2FeO4 происходит разложение: 4K2FeO4 + 10H2O 4Fe(OH)3 + 3O2 + 8KOH
Оксид железа (VI) FeO3 и гидроксид железа (VI) – железная кислота H2FeO4 не получены в свободном виде, теоретически они должны проявлять кислотные свойства.
Таким образом, с повышением степени окисления железа:
1) усиливается кислотный характер оксидов и гидроксидов, ослабевает основной;
2) усиливаются окислительные свойства соединений и ослабевают восстановительные;
3) уменьшается устойчивость соединений.
Железо входит в побочную подгруппу VIII группы, особенность которой состоит в том. что она включает в себя 9 элементов – 3 триады. Наибольшее сходство этих элементов наблюдается не в вертикальных столбцах, а в горизонтальных триадах. Причем первая триада – семейство железа, куда входят Fе, Со, Ni, – наиболее сильно отличается от остальных элементов подгруппы (платиновых металлов). В ряду Fе – Со – Ni химическая активность понижается. В обычных условиях Со и Ni довольно устойчивы по отношению к кислороду. Элементы семейства железа образуют оксиды типа ЭО и Э2О3, которым соответствуют гидроксиды Э(ОН)2 и Э(ОН)3. Однако, если для железа наиболее устойчивыми являются соединения со степенью окисления +3, то для кобальта и никеля +2.
Подобным образом следует давать характеристику любому элементу с приведением соответствующих уравнений реакций.
Задания для самостоятельной работы
2.39. Оксид меди (II) растворяется:
1) в воде при обычной температуре 3) в разбавленных кислотах при нагревании
2) в воде при нагревании 4) в разбавленных растворах щелочей.
2.40. В схеме
превращений: FeCl2
![]() X1
X1
![]() X2 веществом Х2
является 1) FeO 2) Fe(OH)3 3)
FeCl2 4) FeCl3
X2 веществом Х2
является 1) FeO 2) Fe(OH)3 3)
FeCl2 4) FeCl3
2.41. При прокаливании Cr(OH)3 образуется вода и:



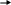 4р – – –
4р – – –