
- •Глава II
- •§ 1. Общая характеристика металлов и их физические свойства
- •§ 3. Химические свойства серебра
- •§ 4. Применение золота и серебра
- •Глава III
- •§ 1. Типы руд и месторождений. Добыча золота и серебра
- •§ 2. Минералы золота
- •§ 3. Минералы серебра
- •§ 4. Общие принципы извлечения золота и серебра из рудного сырья
- •Глава IV подготовка руд
- •§ 1.Дробление и измельчение
§ 3. Химические свойства серебра
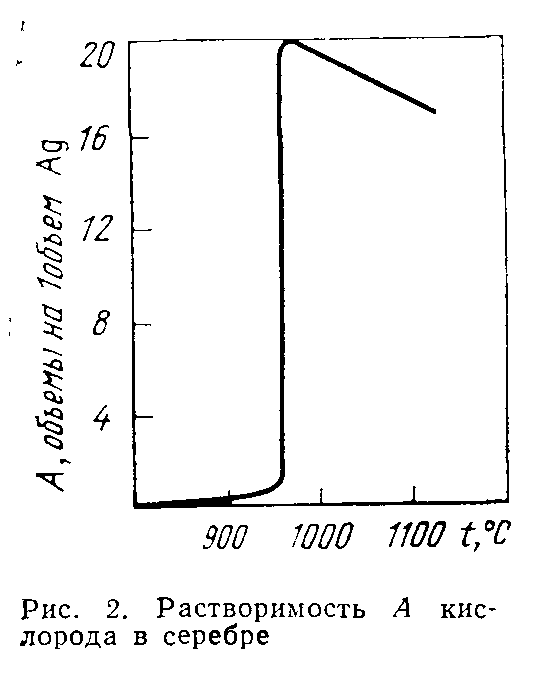
По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла (рис. 2). В твердом серебре раство-
ляющеися при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных ус-.ловиях и является причиной постепенного потемнения се-ребянных изделий. Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают,
даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок
Ag-+Ag+ + e, Фо=+0,799В.
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl. Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомоче-вины в присутствии солей железа (III).
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag20 черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag^. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
Ag+ + ОН~= AgOH; 2AgOH = Ag20 + Н20.
(24) (25)
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гид-ролнзуются и дают нейтральную реакцию. При нагревании до 185—190 °С Ag20 разлагается на элементы. Перекись водорода легко восстанавливается Ag20 уже при комнатной температуре:
Ag20 + Н202 = 2Ag + Н20 + 02.
В водном растворе аммиака Ag20 растворяется с образованием комплексного соединения:
Ag20 + 4NH4OH - 2Ag(NH3)2OH + 3H20.
(26)
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра — малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и ноднд Agl выпадают в осадок при введении в раствор, содержащий ионы Ag+ (например, раствор AgN03), ионов CP, В г- и I-. Их произведения растворимости составляют соответственно 1,8-10-10 (AgCl), 5,3-Ю-1» (AgBr) и8,3-10-'7 (Agl).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НС1. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °С.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN~, S2O3", SOl~ CP, NH3, CS(NH2b и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN~ = Ag (CN)7 + СП;
AgCl -4- 2S2Cf - = Ag (S202)l~ + CP;
AgCl + 2NH4OH = Ag(NH3)t + CP + 2H20.
(27) (28) (29)
Вследствие образования комплексов с ионами CP хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
AgCl + CP = AgCP.
(30)
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7-10_3 моль/л (0,72 г/л Ag) против 1,3-Ю-5 в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в результате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид Agl — наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN~ и S203~ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью Agl обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов Agio".
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувствительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид: 2Agr = 2Ag-r-r2.
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgKAgCKAgBr, поэтому чаще всего для производства фотоматериалов используют бромид серебра.
К галогенидам серебра очень близок по своим свойствам цианид AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag4-, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3-10-16) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgN03 получают действием азотной кислоты на металлическое серебро:
3Ag 4- 4HN03 = 3AgN03 + NO + 2H20. (31)
Нитрат серебра представляет собой бесцветные негиг-роскопические кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgN03 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100°С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNC>3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2S04 может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2H2S04 = Ag2S04 + S02 + 2H20. (32)
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660 °С. При температуре выше 1000 °С термически разлагается. Растворимость Ag2S04 в воде невелика, при 25 °С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHS04.
Сульфид серебра Ag2S — наиболе трудно растворимая соль этого металла (произведение растворимости 6.3X Х10~50). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха;
4Ag + 2H2S + 02 = 2Ag2S + 2Н20. (33)
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN~ ц£ 2Ag (CN)7 + S2~. (34)
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN~ и удале
ние ионов S2~ окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Ag2S -f - 02 = 2Ag + S02. (35)
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN~ 4- 02 + 2Н20 = 4Ag(CN)7 4- 4С4Г. (36)
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III), образуя комплексные катионы Ag[CS(NH2)2]-i~
