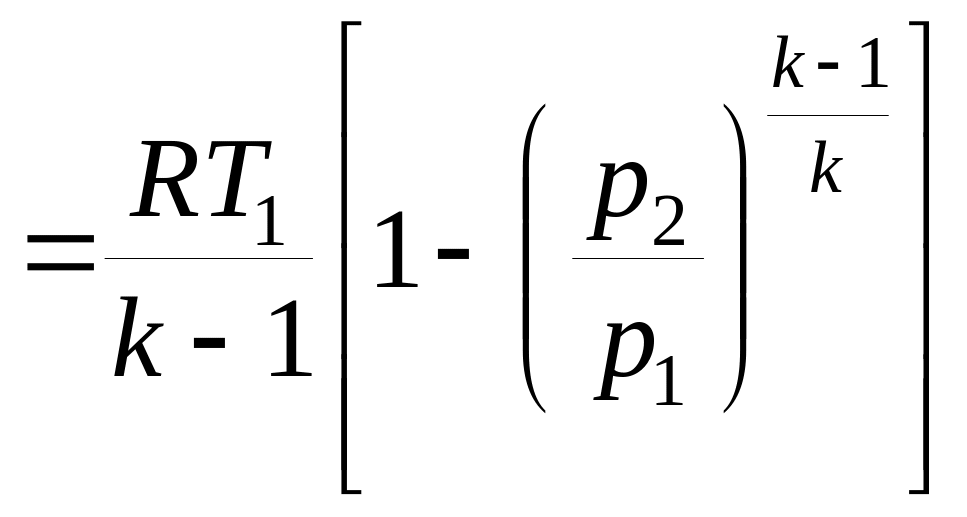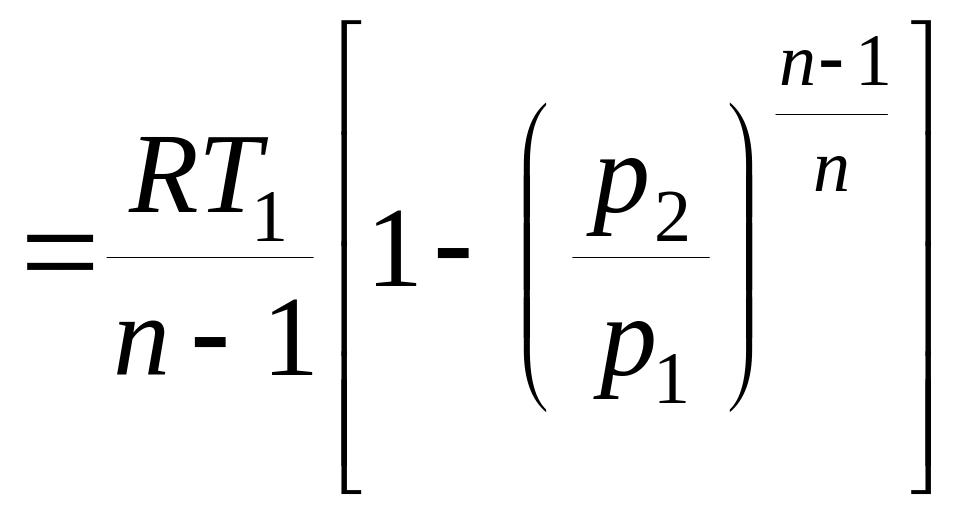Практическое занятие 5
Тема: «ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ С
ИДЕАЛЬНЫМИ ГАЗАМИ»
1. Изохорный процесс
Уравнение изохорного
процесса:
![]() .
.
Выражения для расчета:
- работы изменения
объема
![]() ;
;
- количества теплоты
![]() ;
;
- изменения
внутренней энергии
![]() ;
;
- изменения энтальпии
![]() ;
;
- изменения энтропии
![]() ;
;
Теплоемкость: с = с.
Графики процесса в р и Ts – диаграммах представлены на рис 1. Схема распределения энергии в изохорном процессе представлена на рис. 2.
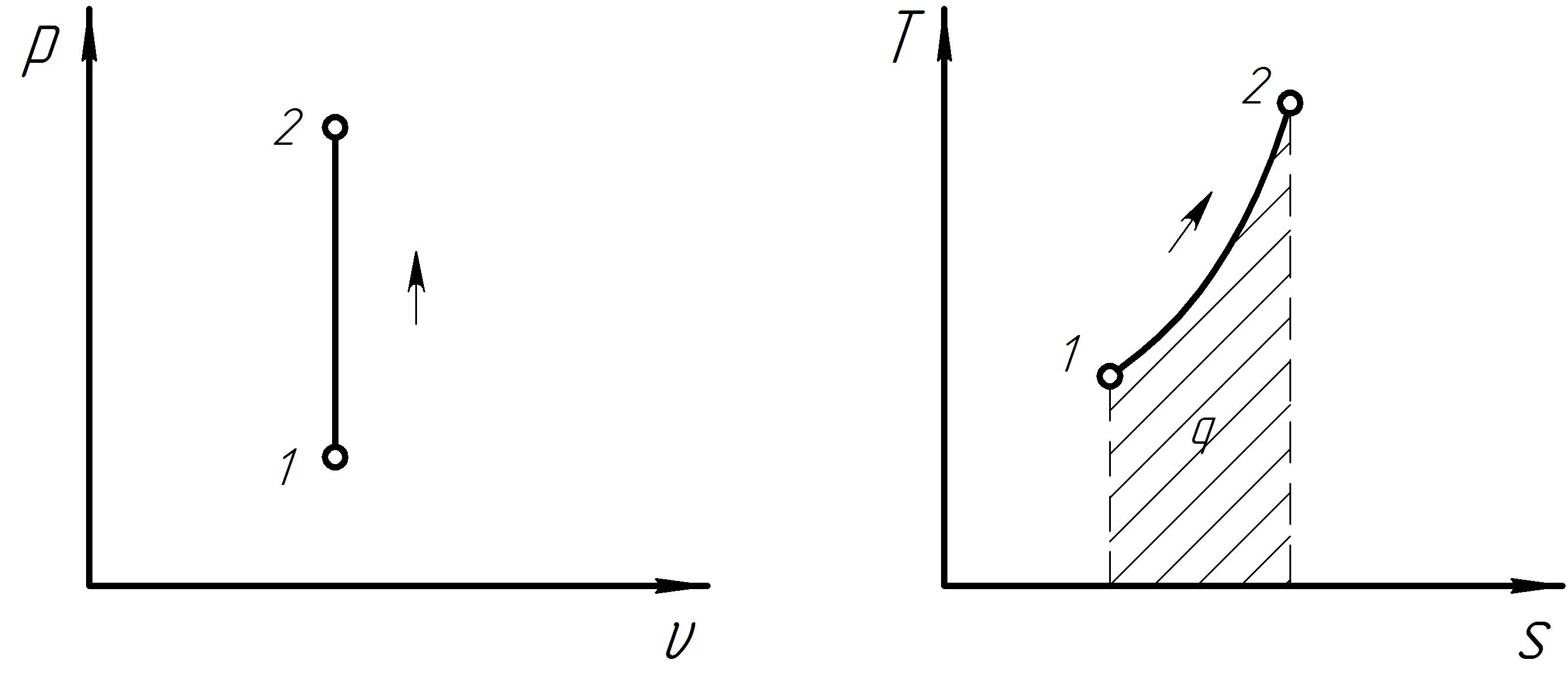
Рис. 1. Графики термодинамического процесса при = const.

2. Изобарный процесс
Уравнение изобарного
процесса:
![]() .
.
Выражения для расчета:
- работы изменения
объема
![]() ;
;
- количества теплоты
![]() ;
;
- изменения
внутренней энергии
![]() ;
;
- изменения энтальпии ;
- изменения энтропии
![]() .
.
Теплоемкость: с = ср = с + R.
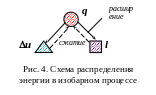
Графики процесса в р и Ts – диаграммах представлены на рис 3. Схема распределения энергии в изобарном процессе представлена на рис. 4.
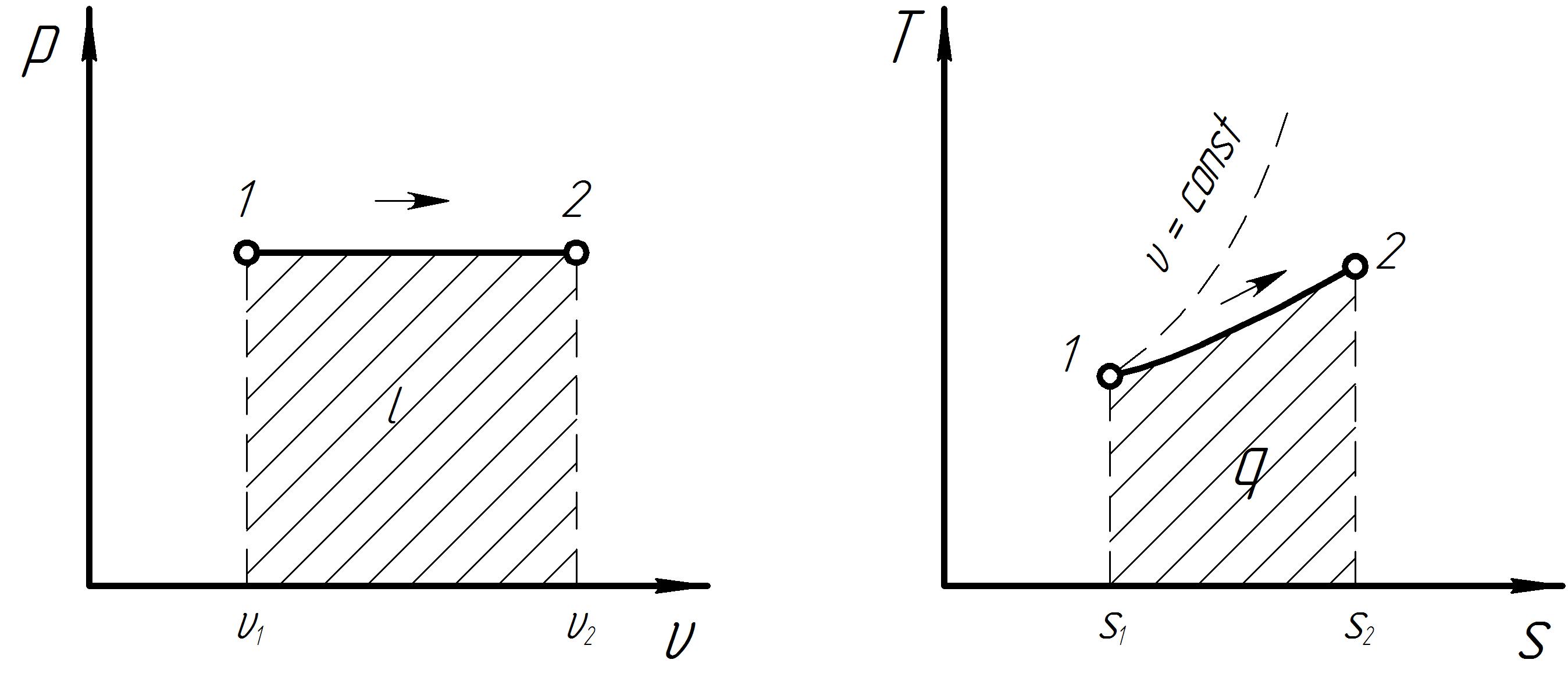
Рис. 3. Графики термодинамического процесса при p = const.
3. Изотермический процесс
Уравнение изотермического процесса: p = const.
Выражения для расчета:
- работы изменения
объема
![]() ;
;
- количества теплоты
![]() ;
;
- изменения внутренней энергии u1-2 = 0;
- изменения энтальпии h1-2 = 0;
- изменения энтропии
![]() .
.
Теплоемкость: с = .
Графики процесса в р и Ts – диаграммах представлены на рис 5. Схема распределения энергии в изотермическом процессе представлена на рис. 6.
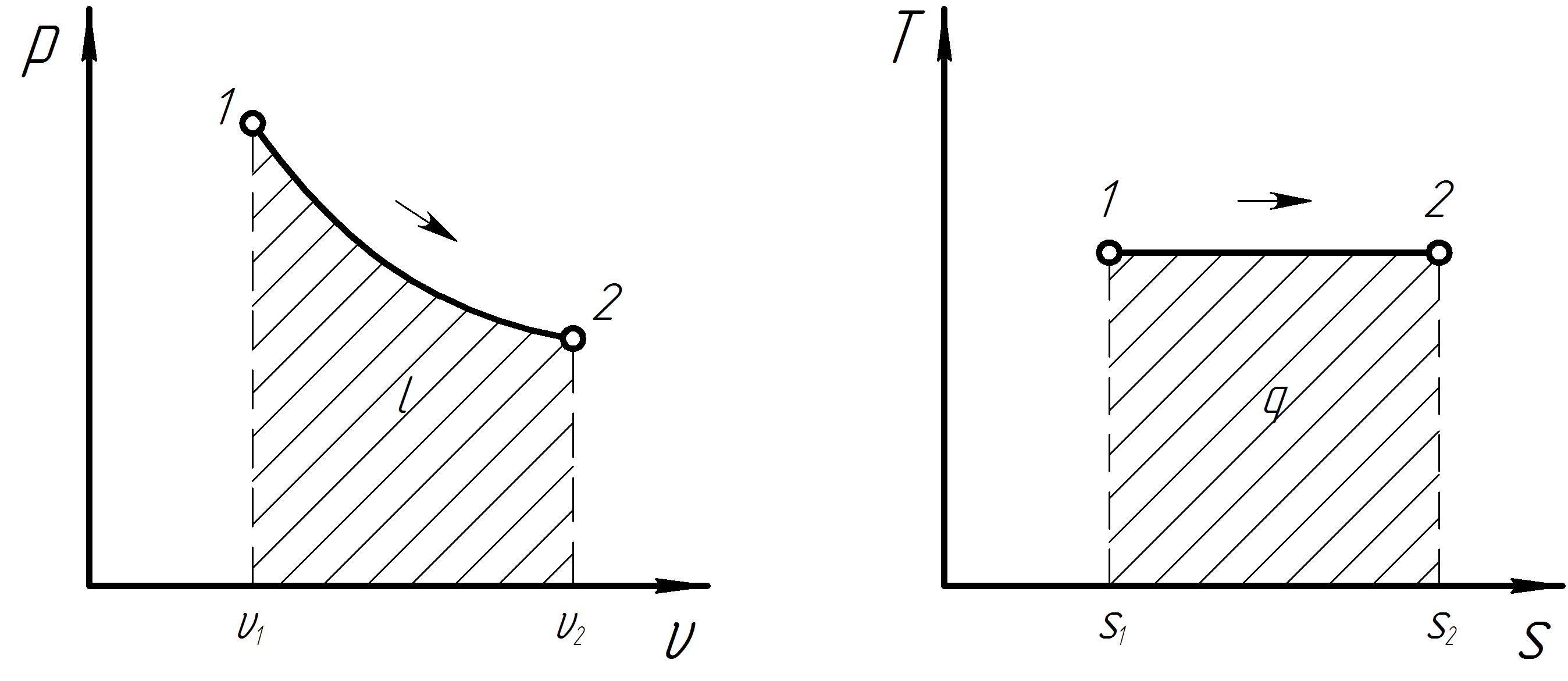
Рис. 5. Графики термодинамического процесса при T = const.
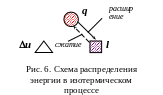
4. Адиабатный процесс
Уравнение адиабатного
процесса:![]() .
.
Соотношения между основными параметрами в адиабатном процессе:
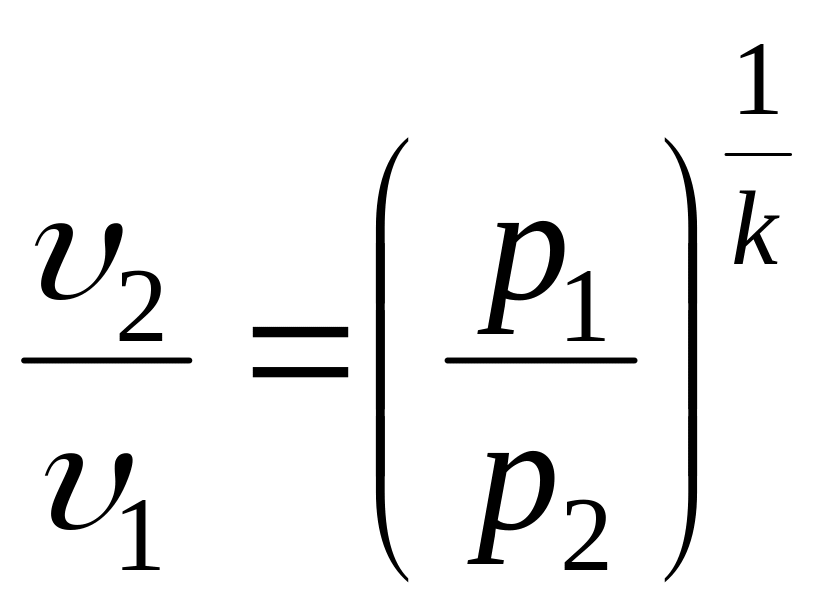 ;
;  ;
; 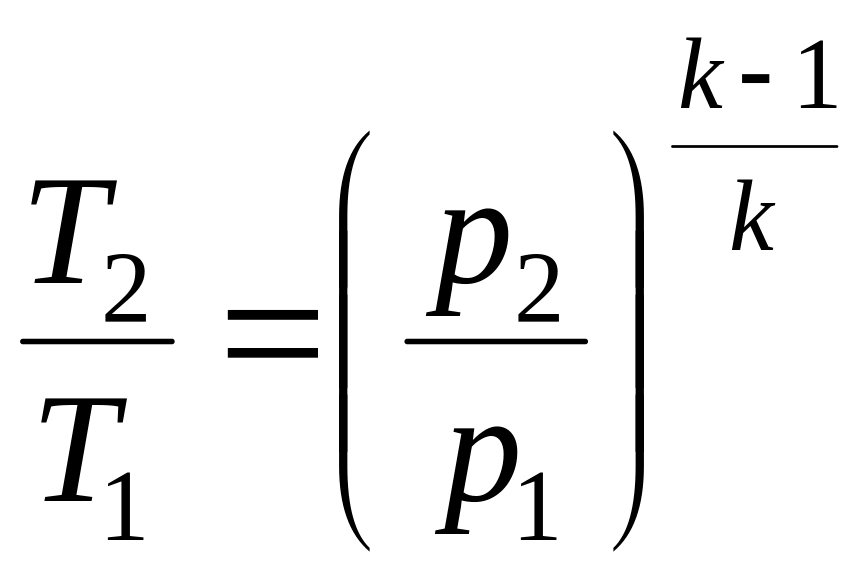 .
.
Выражения для расчета:
- работы изменения объема
|
|
- количества теплоты q1-2 = 0;
- изменения
внутренней энергии
![]() ;
;
- изменения энтальпии
![]() ;
;
- изменения энтропии
![]() .
.
Теплоемкость: с = 0.
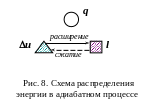
Графики процесса в р и Ts – диаграммах представлены на рис 7. Схема распределения энергии в адиабатном процессе представлена на рис. 8.
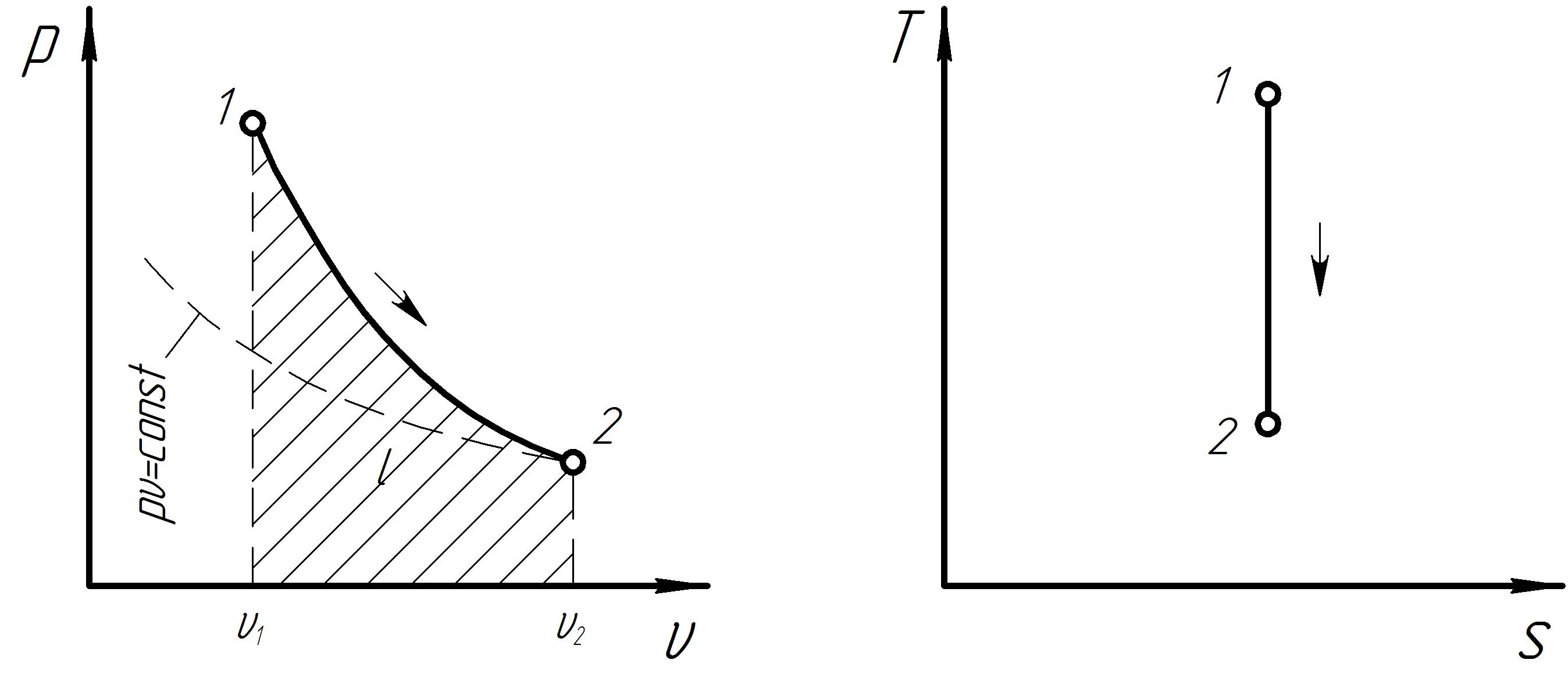
Рис. 7. Графики термодинамического процесса при s = const.
5. Политропный процесс
Уравнение
политропного процесса:![]() ,
,
где
![]() – постоянная величина, называемая
показателем политропы.
– постоянная величина, называемая
показателем политропы.
Соотношения между основными параметрами в политропном процессе:
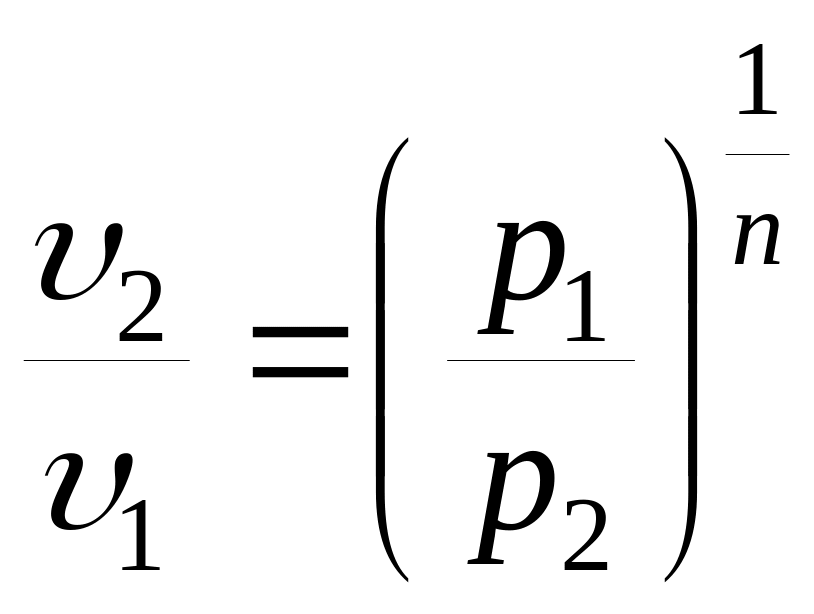 ;
; 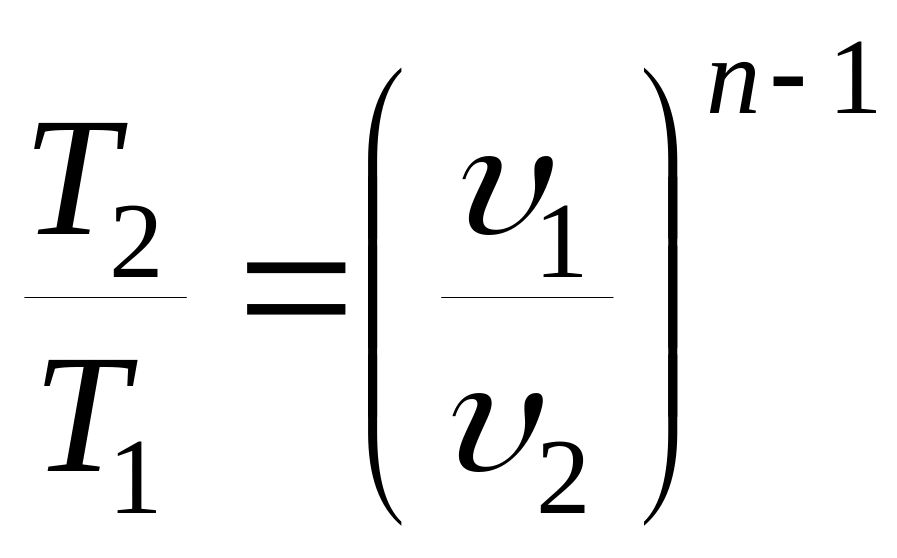 ;
; 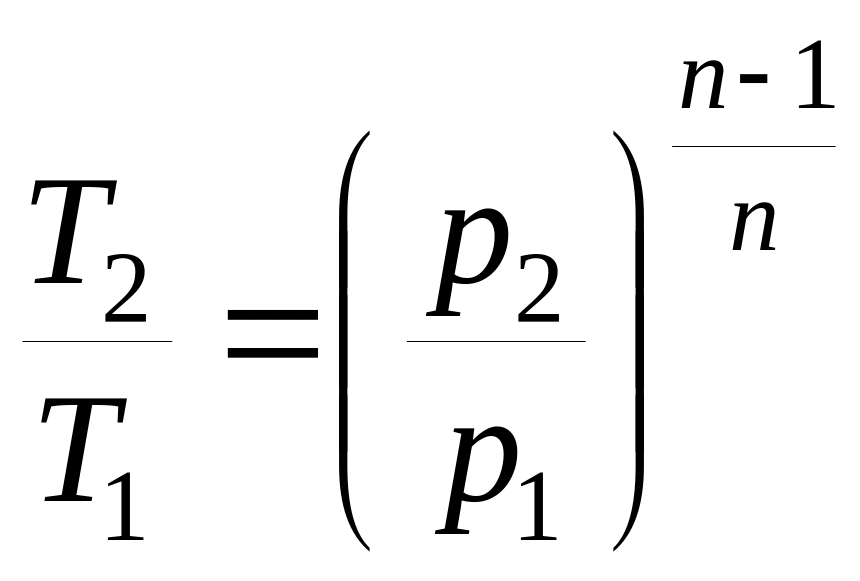 .
.
Выражения для расчета:
- работы изменения объема
|
|
- количества теплоты q1-2 = cn(T2 – T1);
- изменения
внутренней энергии
![]() ;
;
- изменения энтальпии ;
- изменения энтропии
![]() .
.
Теплоемкость:
![]() .
.
Политропных
процессов существует бесчисленное
множество, так как
![]() и
и
![]() .
.
В таблице 1 представлены характеристики каждого процесса. При составлении этой таблицы было принято, что количество рабочего тела равно 1 кг, теплоемкость газа постоянна и четыре основных термодинамических процесса являются частными случаями политропного при соответствующих значениях n.
Таблица 1. Характеристики основных термодинамических процессов идеального газа
№ п.п. |
Характеристика процесса |
Наименование процесса |
||||
изохорный |
изобарный |
изотермический |
адиабатный |
политропный |
||
1 |
Показатель политропы |
|
0 |
1 |
|
|
2 |
Уравнение процесса |
|
|
p = const |
pk = const |
pn = const |
3 |
Теплоемкость, кДж/(кгК) |
c |
cp = c + R |
|
0 |
|
4 |
Изменение
внутренней энергии
|
c(T2 – T1) |
c(T2 – T1) |
0 |
c(T2 – T1) |
c(T2 – T1) |
5 |
Изменение
энтальпии
|
cp(T2 – T1) |
cp(T2 – T1) |
0 |
cp(T2 – T1) |
cp(T2 – T1) |
6 |
Количество теплоты q1-2, кДж/кг |
c(T2 – T1) |
cp(T2 – T1) |
|
0 |
cn(T2 – T1) |
7 |
Работа изменения объема l1-2, кДж/кг |
0 |
p(2 – 1) = = R(T2 – T1) |
|
|
|

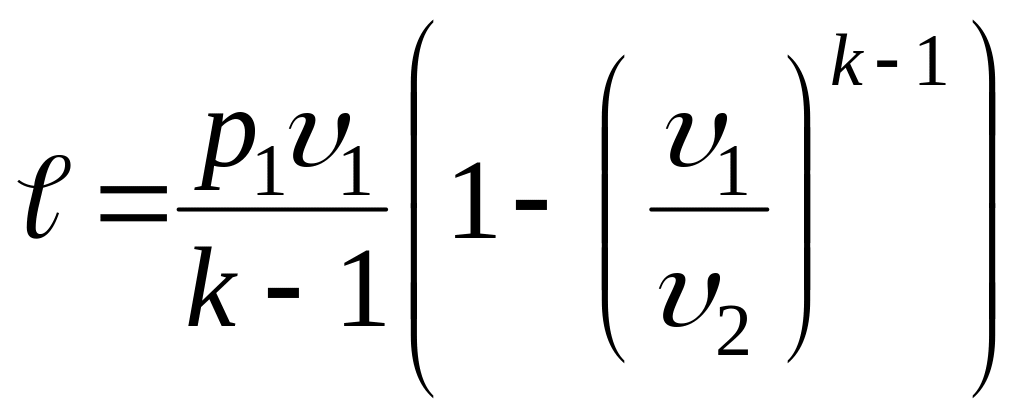 ;
;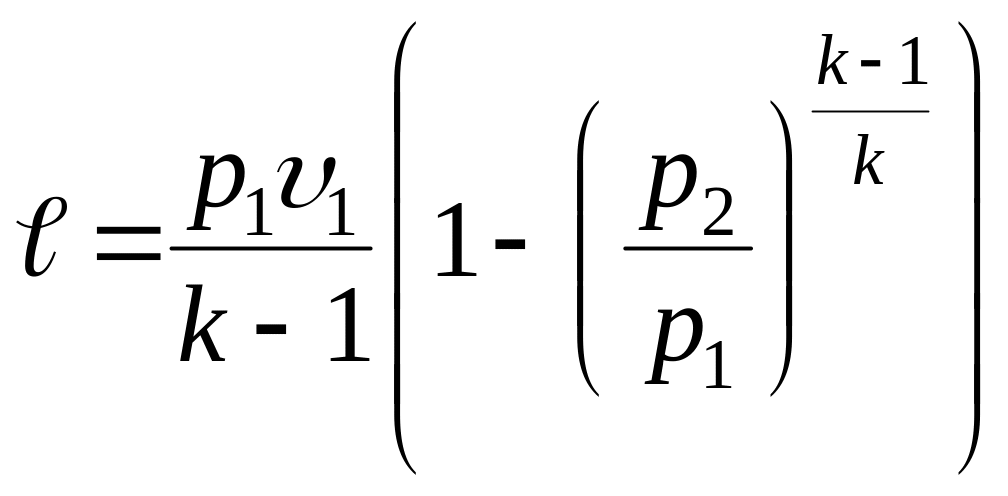 ;
;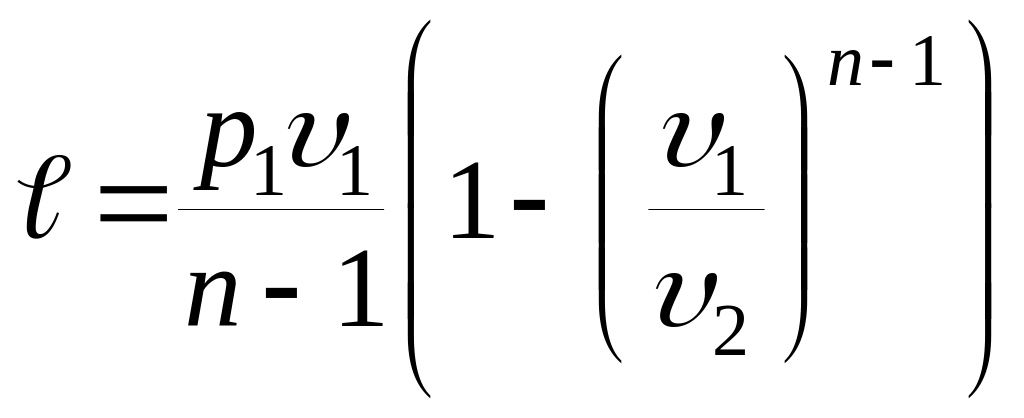 ;
;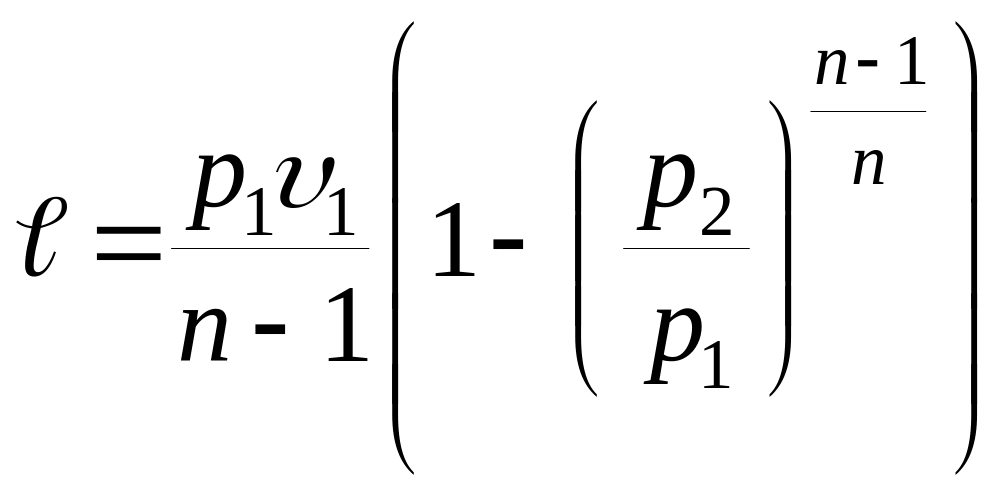 ;
;