
- •Содержание
- •Лабораторная работа 1 исследование продуктов ферментативного гидролиза крахмала под действием α – амилазы
- •Лабораторная работа 2 исследование продуктов гидролиза сахаров под действием зимазного комплекса дрожжей
- •Лабораторная работа 3 исследование продуктов гидролиза белков под действием протеолитических ферментов
- •Лабораторная работа №4. Выделение простых и сложных белков из пищевого сырья и их фракционирование
- •1.2 Общие сведения
- •1.3 Практическая часть
- •1.3.1 Опыт 1. Разделение альбуминов и глобулинов яичного белка методом высаливания
- •1.3.1.1 Методика выполнения работы
- •1.3.3.1 Методика выполнения работы
- •1.3.3.2 Оформление результатов опыта
- •1.3.4 Опыт 4. Колориметрический метод определения содержания доступного лизина
- •1.3.4.1 Подготовка к анализу
- •1.3.4.1.1 Методика очистки красителя «Оранж ж»
- •1.3.4.1.2 Приготовление раствора красителя
- •1.3.4.1.3 Построение градуировочного графика
- •1.3.4.2 Методика выполнения работы
- •1.3.4.3 Оформление результатов опыта
- •1.4 Контрольные вопросы
- •Лабораторная работа №5. Определение количества сахаров в сырье и продуктах растительного происхождения.
- •2.2 Общие сведения
- •2.3 Практическая часть
- •2.3.1 Опыт 1. Определение редуцирующих сахаров в продуктах растительного происхождения по Иссекутцу
- •2.3.1.1 Методика выполнения работы
- •2.3.1.2 Оформление результатов опыта
- •2.3.2 Опыт 2. Определение глюкозы по методу Вильштеттера и Шудля
- •2.3.2.1 Методика выполнения работы
- •2.3.2.2 Оформление результатов опыта
- •2.3.3 Опыт 3. Определение сахарозы
- •2.3.3.1 Методика выполнения работы
- •2.3.3.2 Оформление результатов опыта
- •2.4 Контрольные вопросы
- •Лабораторная работа №6. Определение изменения перекисного числа и содержания изомеров кислот с сопряженными связями в пищевых продуктах в процессе технологической обработки.
- •3.2 Общие сведения
- •3.3.3 Опыт 2. Определение перекисного числа масла.
- •3.3.3.1 Методика выполнения работы
- •3.3.3.2 Оформление результатов
- •2.4 Контрольные вопросы
- •Лабораторная работа №7. Влияние температуры и рн среды на активность α-амилазы
- •4.2 Общие сведения
- •4.3 Практическая часть
- •4.3.1 Приготовление препаратов α-амилазы
- •4.3.2 Методика выполнения работы
- •4.3.3 Оформление результатов опыта
- •4.4 Контрольные вопросы
- •Литература
- •Лабораторная работа №8. Влияние продуктов жизнедеятельности дрожжей на клейковину и растворимость белков муки
- •5.2 Общие сведения
- •5.3 Практическая часть
- •5.3.1 Методика выполнения работы
- •5.4 Контрольные вопросы
- •Лабораторная работа №9. Изучение перевариваемости белков хлеба методом ансона
- •6.2 Общие сведения
- •6.3 Практическая часть
- •6.3.2 Оформление результатов опыта
- •6.4 Контрольные вопросы
- •Лабораторная работа № 10 определение содержания витаминов в растительном сырье при его обработке.
- •7.2 Общие сведения
- •7.3 Практическая часть
- •7.3.1 Опыт 1. Фотоколориметрическое определение ниацина (витамина рр)
- •7.3.1.1 Методика выполнения работы
- •7.3.1.2 Оформление результатов
- •7.3.2 Опыт 2. Фотоколориметрический метод определения аскорбиновой кислоты
- •Приготовление полунасыщенного раствора гидрохинона
- •Приготовление раствора ацетатного буфера с рН 4,0
- •7.3.2.1 Методика выполнения работы
- •7.3.2.2 Оформление результатов
- •7.4 Контрольные вопросы
Лабораторная работа 3 исследование продуктов гидролиза белков под действием протеолитических ферментов
Цель работы: Освоить метод определения активности протеолетических ферментов.
Общие сведения
Протеолитические ферменты катализируют расщепление белковых веществ до пептидов и дальнейший гидролиз этих продуктов до аминокислот. Распад белков и продуктов их гидролиза происходит по месту пептидных связей по следующей схеме:
![]()
где R| и R2 - остатки аминокислот или пептидов.
Протеазы делятся на две группы - протеиназы иг пептидазы.
Пептидазы обладают очень большой специфичностью действия и делятся на три группы: аминопептидазы, карбоксипептидазы и дн-- пептидазы. Аминопеотадазы катализируют расщепление полипептидов по месту пептидной связи, расположенной у того конца пептида, на котором имеется свободная аминная груша:

где R1, R2, R3 - остатки аминокислот; стрелкой показано место действия аминопептидазы.
Карбоксипетидаза
расщепляет в полипептидах пептидную
связь
у того конца пептида, где имеется
свободная карбоксильная группа: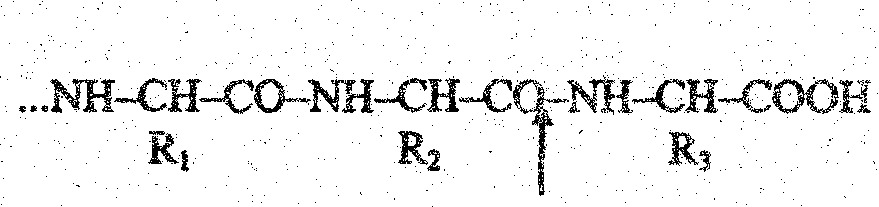
где R1, R2, R3 ~ остатки аминокислот; .стрелкой показано действие . карбоксипептидазы.
Во всех продуктах растительного происхождения протеиназы и пептидазы присутствуют вместе, поэтому гидролиз белков происходит до конца (до аминокислот).
Принцип метода: Определить активность протеолитических ферментов можно следующими способами;
автолизом, когда навеску исследуемого материала заливают водой, прибавляют антисептик (например, тимол или толуол) и под влиянием ферментов, находящихся в клетках этого же растительного материала, собственный белок расщепляется;
действием вытяжки фермента на препарат белка или какой-либо другой субстрат;
3) выделением ферментов из растительных тканей, очисткой этих ферментов и определением их действия на белки или препараты растительных тканей. Чаще всего активность протеолитических ферментов определяют более простым первым методом.
Активность протеаз учитывают обычно по количеству освобождающихся аминных или карбоксильных групп в навеске материала за определенный отрезок времени. Определение аминных групп можно проводить метопом Ван-Сляйка или методом Несслера.
Приборы к реактивы: колбы конические на 100 мл, колбы мерные на 100 мл; фосфатный буфер 1/15 М с рН 5,6 (0,5 мл 1/15 М Nа2НРО4 и 9,5 мл 1/15 М КН2Р04); толуол; реактив Несслера (растворяют 25 г йодистого калия в 50 мл воды, прибавляют 35 г йодистой ртути красной и в фарфоровой ступке пестиком растираю до полного растворения). Прибавляют 870 мл 15%-ного раствора КОН перемешивают, дают отстояться и декантируют прозрачную жидкость. Раствор хранят в темной склянке); сегнетовая соль 25%-ная. образцовый раствор NH4Cl (0,7405 г х.ч. перекристаллизованного хлорида аммония растворяют в дистиллированной безаммиачной воде и доводят объем до 1 л, 20 мл этого раствора переносят в мерную колбу на 1 л, доводят объем до метки, 1 мл этого раствора содержит 0,005 мг NH4.
Методика выполнения работы: Навеску 10 г муки помещают; г в коническую колбу емкостью 100 мл, приливают 50 мл дистиллированной воды, 20 мл фосфатого буфера (рН 5,6), 0,5 мл толуола,
При изучении активности ферментов в зависимости от температуры колбы с буфером выдерживают при различных температурах (3-8о; 16-24о; 35о; 50о) в течение 24 часов.
Обязательно ставят контрольную колбу с инактивированными ферментами. Инактивацию проводят кипячением содержимого колбы в течение 3--5 минут.
После соответствующей экспозиции колбы вынимают из термостата, фильтруют в мерную колбу на 100 мл, доводят до метки водой и 10 мл раствора используют для определения аминного азота методом Hесслера, после этого доводят объем до метки Периодическое разбавление опытного раствора при добавлении реактива Несслера обеспечивает получение прозрачного раствора чисто-желтого цвета.
Содержание в растворе аммония устанавливают по калибровочной кривой образцовых растворов. Для построения ее готовят образцовые растворы одновременно с испытуемым раствором. В мерные колбы на 100 мл помещают 0,5; 1; 2; 4 мл рабочего образцового раствора хлористого аммония, добавляют воды до половины объема, а затем раствор сегнетовой соли и реактив Несслера.
Просмотр окраски образцового и испытуемого растворов проводят через 10 минут после прибавления реактива Несслера при длине волны λ= 400 нм.
Содержание аммонийного азота (%) рассчитывают ко формуле

где а - количество азота по графику, мг,
в - общий объем раствора, мл (500),
с - объем раствора, взятый для окрашивания, мл;
а - навеска воздушно-сухого материала, г;
1000 - перевод мг в г.
Оформление работы
Образец |
Температура воздействия, оС |
Показания прибора |
Количество азота по графику |
Содержание азота, % |
Контрольный |
|
|
|
|
Опытный |
|
|
|
|
Контрольные вопрсы
Дайте классификацию ггротеолетических ферментов.
Что является субстратом для действия протеаз?
Каковы продукты гидролиза белков?
В чем заключается значение протеаз в хлебопечении?
Какие вам известны ферментные препараты протеолитического действия?
Какова сущность метода определения активности протеолитических ферментов?
Рекомендуемая литература
[7] с 118-123, [11] с. 99-133, [13] с. 1S6-P7
