
- •Химическая связь
- •Основные характеристики химической связи
- •Ковалентная химическая связь
- •Метод валентных связей
- •Кратные химические связи
- •Делокализованная химическая связь
- •Достоинства и недостатки метода валентных связей
- •Метод молекулярных орбиталей
- •Двухатомные молекулы и ионы элементов I-го периода
- •Двухатомные молекулы и ионы элементов II-го периода
- •Ионная химическая связь
- •Металлическая связь
- •Межмолекулярное взаимодействие
Двухатомные молекулы и ионы элементов I-го периода
У атомов водорода и гелия заняты электронами 1s-орбитали, которые участвуют в построении молекулярных. Если волновые функции 1s-орбиталей имеют одинаковые знаки (электронные волны находятся в одинаковых фазах), то происходит слияние атомных электронных облаков с образованием связывающей МО. В противном случае образуется разрыхляющая МО:
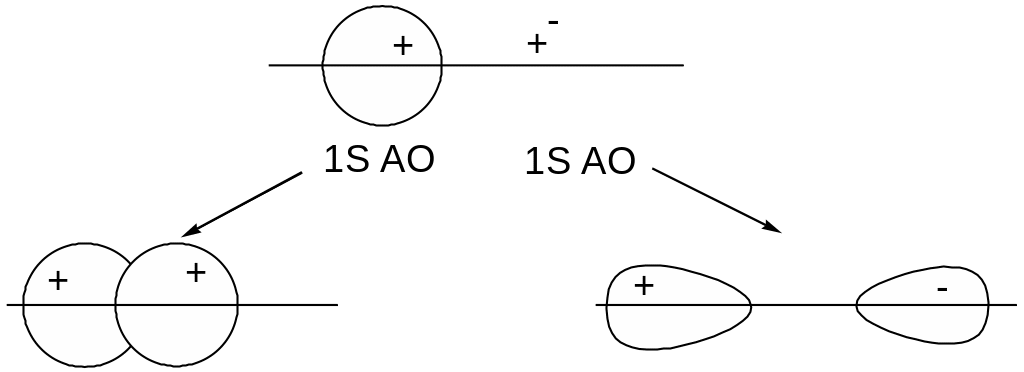
s-связывающая МО s*-разрыхляющая МО
На энергетических диаграммах МО обозначаются также, как и АО, т.е. квадратиком, кружком или черточкой. Простейшей двухъядерной частицей является молекулярных ион водорода H2+, который образуется из атома и иона водорода: H + H+H2+, а энергетическая диаграмма для этого иона имеет вид:

Кратность связи
КС=(2-0)/2=1
E=435 кДж/моль, r=0,074 нм
образуется двухэлектронная связь, необъяснимая в методе
Возможно образование молекулярного иона гелия He + He+He2+:

E=238 кДж/моль, r=0,108 нм, кратность связи КС=(2-1)/2=0,5, возникает трехэлектронная связь, необъяснимая в методе ВС.
Легко показать, что молекула He2 не существует, т.к. на s* орбитали будет два электрона и КС=0, что согласуется с методом ВС.
Для рассмотренных частиц в методе МО принят такой способ указания их электронного строения: H2+[s1], H2[s2], He2+[s2(s*)1].
Двухатомные молекулы и ионы элементов II-го периода
Атомы этих элементов во внешнем электронном слое содержат четыре АО – 2s, 2px, 2py и 2pz, которые образуют восемь МО по четыре связывающих и разрыхляющих.
Внутренние 1s2 электроны не принимают участие в построении МО.
Вид молекулярных орбиталей определяется формой и расположением в пространстве исходных атомных орбиталей.
Два АО 2s образуют s s* МО такой же формы, как и у ранее рассмотренных молекул и ионов элементов I-го периода. АО 2р могут комбинироваться двумя различными способами:

разрыхляющая МО связывающая МО
или:
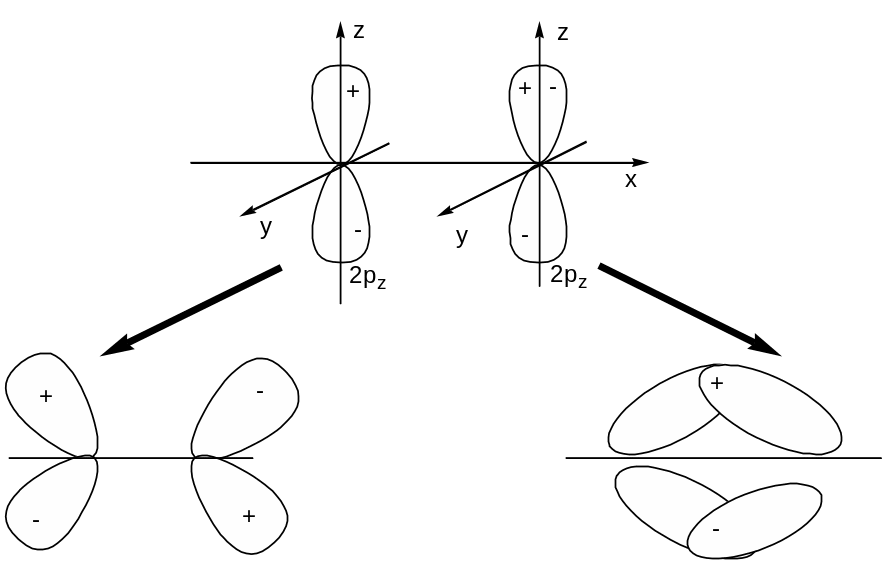
разрыхляющая МО связывающая МО
в плоскости xz
Атомные орбитали 2ру образуют такие же по форме МО y и y*, но лежащими в плоскости ху.
Энергетическая последовательность МО характеризуется рядом:
s<s* s<s* |
<y=z<x <x<y=z |
<y*=z*<x* <y*=z*<x* |
По N2 включительно После N2 |
Рассмотрим электронное строение молекулы О2, которое не имеет удовлетворительного объяснения в методе ВС:
O2 [(s)2(s*)2(2)2 (y)2(z)2(y*)1(z*)1], E=493 кДж/моль, r=0,121 нм, КС=(8-4)/2=2, О=О.

Диаграмма приведена для О2
Таким образом, в молекуле кислорода связь двойная, что не противоречит методу ВС. Однако метод МО естественно приводит к наличию в молекуле O2 двух неспаренных электронов и объясняет экспериментально установленный парамагнетизм кислорода, который не следует из метода ВС.
В молекулярном ионе кислорода O2+ удаляется один электрон с разрыхляющей y* или z* орбитали, что приводит к возрастанию кратности связи, повышению прочности связи и сокращению межъядерного расстояния: КС=(8-3)/2=2,5, E=629 кДж/моль, r=0,112 нм.
Для гетероядерных (образованных из разных атомов) двухатомных молекул элементов II-го периода энергетическая диаграмма и последовательность заселения электронами молекулярных орбиталей остается той же, что и для гомоядерных молекул, но следует учесть меньшую энергию электронов на атомных орбиталях у более электроотрицательного атома.

Энергетическая диаграмма МО гетероядерной молекулы АВ, где A имеет меньшую электроотрицательность, чем B.
Рассмотрим электронное строение молекулы CN (циана) c упрощенным изображением энергетической диаграммы, C 1s22s22p2, N 1s22s22p3:

Электронная формула молекулы CN [(s)2(s*)2(y)2(z)2(x)1]. Кратность связи КС=(7-2)/2=2,5, E=745 кДж/моль, r=0,117 нм.
Молекула CN является псевдогалогеном и обладает большим сродством к электрону CN + e CN-, что обусловлено приходом дополнительного электрона на x орбиталь. Это приводит к повышению кратности связи и при незначительном сокращении межъядерного расстояния к довольно сильному увеличению прочности связи в цианид-ионе CN- по сравнению с молекулой CN. В ионе CN- КС=(8-2)/2=3, (C≡N)-, E=991 кДж/моль, r=0,115 нм.
Таким образом, отрыв или присоединение электронов, изменяющие их количество на связывающих или разрыхляющих МО, приводит к изменению кратности связи и других характеристик молекул и ионов.
Несвязывающие и неразрыхляющие молекулярные орбитали имеются, например, в молекуле фтороводорода HF. Атомные орбитали 1s атома водорода и 2s атома фтора при одинаковой симметрии не комбинируют между собой из-за большой разницы в энергиях их электронов, а орбитали 2py и 2pz – вследствие разной симметрии.
Схематическое представление σсв связывающей МО HF

Схематическое представление несвязывающей и разрыхляющей МО HF:

Энергетическая диаграмма МО имеет указанный вид (рис.), а электронная формула молекулы HF [(sn)2(sp)2(yn)2(zn)2]

Несвязывающие и неразрыхляющие МО - sn, yn и zn.
Кратность связи в молекуле HF RC=(2-0)/2=1, H-F.
Энергетическая диаграмма МО молекулы СО:
AOC МОСО АОО

Многоатомные молекулы
Энергетическая диаграмма МО молекулы BeH2
AOВе МОВеН2 АОН

В линейные комбинации включают только близкие по энергии и перекрывающиеся АО.

Таким образом, метод молекулярных орбиталей, несмотря на малую наглядность, значительно лучше передает электронную структуру молекул, объясняет и предсказывает их свойства, чем метод валентных связей.
Ковалентная химическая связь характеризуется насыщаемостью, направленностью и поляризуемостью.
Насыщаемость ковалентной связи проявляется в том, что каждый атом может образовать не произвольное, а строго определенное число химических связей в зависимости от количества неспаренных электронов на внешнем электронном слое с учетом возбужденных и ионизированных состояний атома, а также возможности образования донорно-акцепторной связи.
Направленность ковалентной химической связи обусловлена формой и направленостью электронных облаков в пространстве и определяет геометрическую конфигурацию молекул. Уголковая структура молекула H2S и пирамидальная – PH3 следует из того, что p-орбитали располагаются под углом 90 друг к другу:

Полярность ковалентной химической связи.
Полярность связи обусловлена смещением (сдвигом) связывающих электронных пар от атомов с меньшей и атомам с большей электроотрицательностью.
Неполярная связь образуется между атомами одного и того же элемента. В молекулах H2, N2, O2, Cl2 и т.п. связи неполярны, центры тяжести положительных и отрицательных зарядов у этих молекул совпадают. Связь между атомами разных элементов всегда в большей или меньшей степени полярна. Чем больше разница в электроотрицательностях таких атомов, тем более полярна связь.
|
|
|
В молекуле хлороводорода HCl связывающая электронная пара смещена к более электроотрицательному атому хлора, центры тяжести положительных и отрицательных зарядов не совпадают, а атомы водорода и хлора приобретают равные по величине, но противоположные по знаку эффективные заряды. Следовательно, молекула хлороводорода представляет собой диполь:
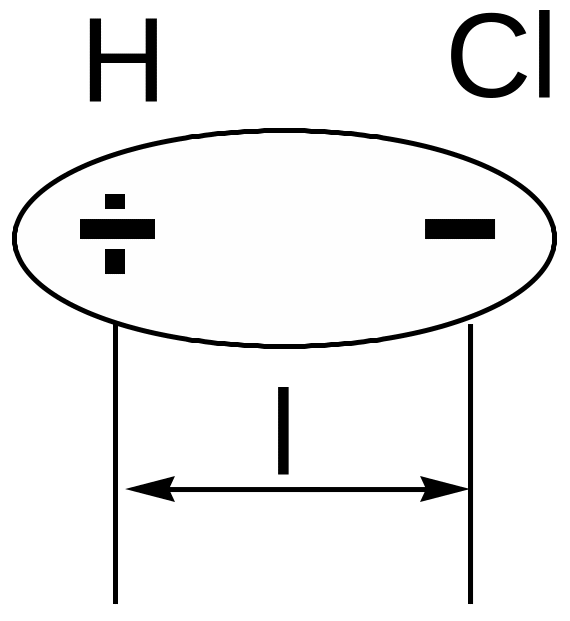
т.е. систему из двух противоположных зарядов, находящихся на некотором расстоянии друг от друга l, называемом длиной диполя.
Количественной мерой полярности связи является дипольный момент связи, определяемый как =el, где е-заряд электрона. За единицу дипольного момента обычно принимают дебай: 1Д=3,3410-30 Клм.
Поляризуемость ковалентной химической связи.
Это свойство связи становиться более полярной (см. далее) под действием электрических полей соседних молекул. Степень полярности связи в электрическом поле увеличивается вплоть до полного разрыва связи с переходом связывающей электронной пары к атому с большей электроотрицательностью. Так, в водной среде в молекуле хлороводорода под действием электрических полей молекул воды полярность связи H-Cl возрастает настолько, что связывающая электронная пара нацело переходит к атому хлора с образованием ионов:
H:Cl H+ + :Cl-



