
- •Класифікація ферментів
- •Структура і механізм дії ферментів
- •Практичне використання ферментів
- •Загальнобіологічні властивості вітамінів
- •Вітамін в6 (піридоксин, антидерматитний)
- •Гомоцистинурія.
- •Вітамін е (токоферол, антистерильний)
- •Вітамін d (кальциферол, антирахітичний).
- •Вітамін к (нафтохінони, антигеморагічний)
Лекція: Біологічно активні речовини.
План.
Ферменти, їх роль у життєдіяльності організмів.
Вітаміни, їх роль у життєдіяльності організмів.
В живих організмах переважна більшість реакцій відбувається за участю ферментів - біологічних каталізаторів білкової природи. Назва “ферменти” походить від латинського “fermentatio” - грецького “en zyme” - в дріжджах. Обидва терміни свідчать про те, що властивість живих клітин прискорювати хімічні процеси здавна відома людям. Термін «фермент» був запропонований у 17 столітті хіміком Яном Баптистою ван Гельмонтомван для опису механізмів травлення.
Виділити ферменти в чистому вигляді вдалося лише в XX столітті. В 1902 р. в лабораторії І. П. Павлова були одержані важливі докази білкової природи ферменту травлення пепсину. В 1926 р. Дж. Самнер виділив у кристалічному вигляді фермент уреазу, який каталізує розщеплення сечовини на аміак і вуглекислий газ, і довів, що це білок. Через чотири роки Дж. Нортроп виділив кристали пепсину. На наш час відомо більше 2000 ферментів і всі вони мають білкову структуру.
Ферменти є біологічними каталізаторами, вони присутні у всіх живих клітинах і сприяють перетворенню одних речовин (субстратів) на інші (продукти). Ферменти виступають в ролі каталізаторів практично у всіх біохімічних реакціях, що відбуваються в живих організмах — ними каталізується біля 4000 хімічно окремих біореакцій. Ферменти грають найважливішу роль у всіх процесах життєдіяльності, скеровуючи та регулюючи обмін речовин організму.
Класифікація ферментів
Оксидоредуктази — ферменти, що каталізують окислення або відновлення. Приклад: каталаза, алкогольдегідрогеназа
Трансферази — ферменти, що каталізують перенесення хімічних груп з однієї молекули субстрата на іншу. Серед трансфераз особливо виділяють кінази, що переносять фосфатну групу, як правило, з молекули АТФ.
Гідролази — ферменти, що каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеїнліпаза
Ліази — ферменти, що каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
Ізомерази — ферменти, що каталізують структурні або геометричні зміни в молекулі субстрата.
Лігази — ферменти, що каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ. Приклад: ДНК-полімераза
Структура і механізм дії ферментів
Деякі ферменти є простими білками. До них належать ферменти, які каталізують реакції гідролізу. Інші, складні білки, містять два компоненти - білковий (апофермент) і небілковий (кофактор).
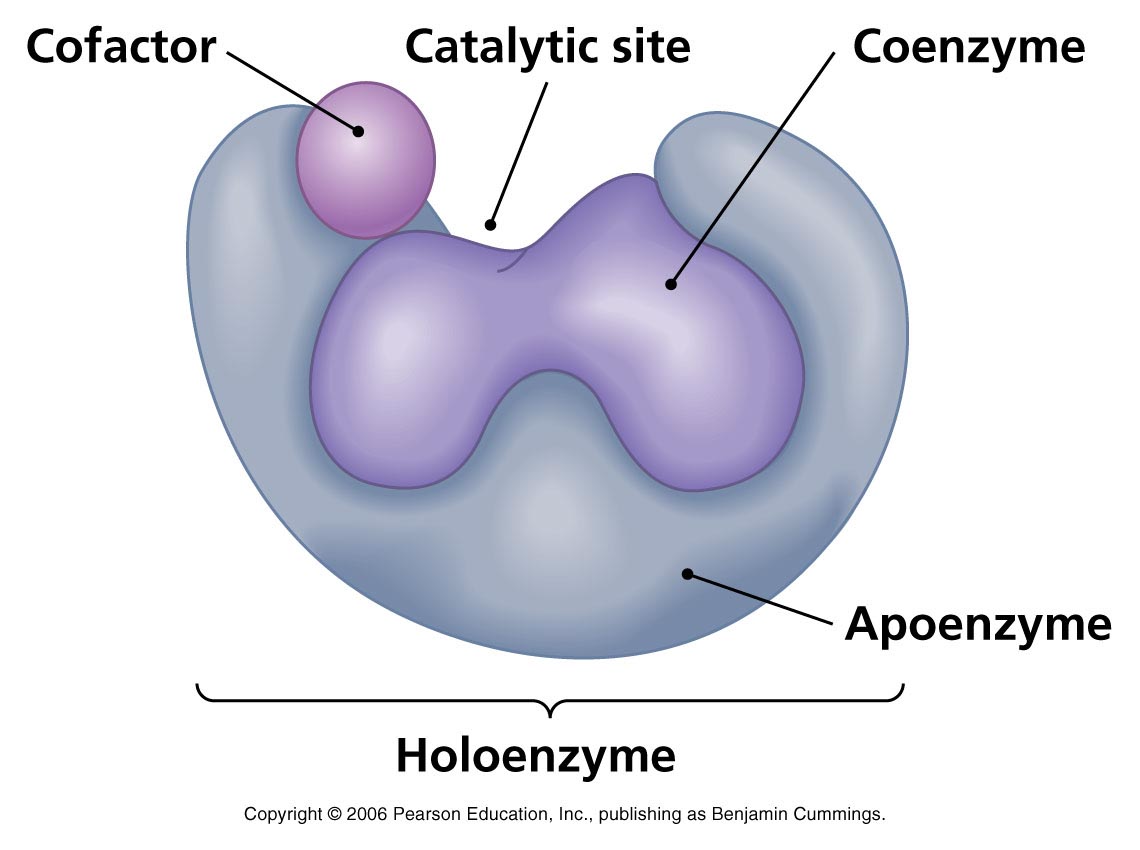
Кофактор може бути простий (неорганічної природи, наприклад, Fe2+, Fe3+, Mn2+, Zn2+, Cu2+, Mo, Se), або складний (органічної природи). Складні кофактори називаються коферментами. Часто вони представлені вітамінами (В1, В6, ВС, В12, Н), або до їх складу входять вітаміни (до НАД+, НАДФ+ - В5, до ФАД, ФМН – В2, до КоАSH – В3).
Активність ферментів визначається їхньою тривимірною структурою. Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, який згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і молекула (білкова глобула), що виходить, володіє унікальними властивостями. Кілька білкових ланцюжків можуть об'єднуватися у білковий комплекс. Найбільші рівні структури білків — третинна та четвертинна структури — руйнуються при нагріванні або під дією деяких хімічних речовин.
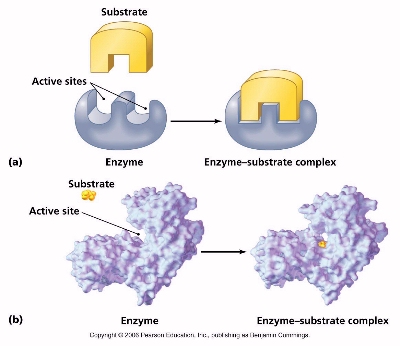
Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або кількома субстратами. Білковий ланцюжок ферменту згортається таким чином, що на поверхні глобули утворюється щілина або западина, до якої приєднуються молекули субстрату. Ця область називається ділянкою (сайтом) зв'язування субстрата. Зазвичай вона збігається з активним центром ферменту або знаходиться поблизу від нього. Деякі ферменти містять також ділянки зв'язування кофакторів або іонів металів.
Ферментативний каталіз відбувається в декілька стадій.
На першій стадії фермент (Е) взаємодіє з субстратом (S), утворюючи фермент-субстратний комплекс (ЕS).
На другій стадії відбувається активація субстрату у складі комплексу (ЕS*).
На третій стадії активований субстрат в складі комплексу перетворюється в продукт (ЕР)
НА четвертій стадії продукти реакції вивільняються, а фермент може здійснювати новий цикл перетворень.
Фермент-субстратний комплекс нестабільний. В більшості випадків його неможливо виділити, а можна лише зареєструвати за допомогою фізичних методів дослідження швидких реакцій.
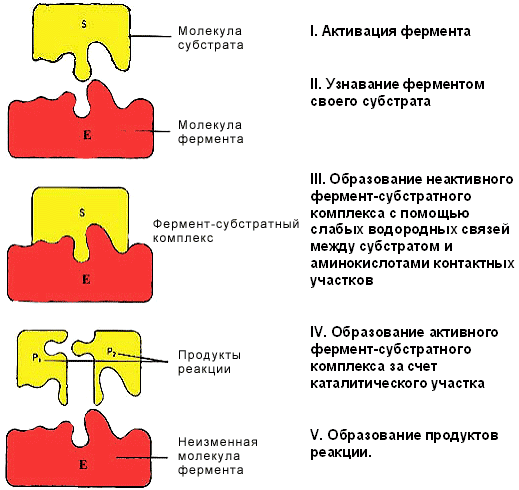
Модель «ключ-замок»
У 1890 році Еміль Фішер припустив, що специфічність ферментів визначається точною відповідністю форми ферменту і субстрата . Таке припущення називається моделлю «ключ-замок». Фермент з'єднується з субстратом з утворенням короткоживучого фермент-субстратного комплексу.
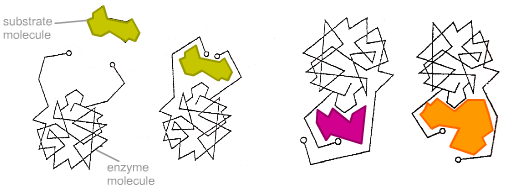
Модель індукованої відповідності
У
1958 році американський дослідник Деніел
Кошланд запропонував модифікацію моделі
«ключ-замок». Ферменти, в основному, —
не жорсткі, а гнучкі молекули. Активний
центр ферменту може змінити конформацію
після зв'язування з ним субстата. Бічні
групи амінокислот активного центру
займають таке положення, яке дозволяє
ферменту виконувати свою каталітичну
функцію. В деяких випадках молекула
субстрата також міняє конформацію після
скріплення в активному центрі.
Для функціонування кожного ферменту потрібні оптимальні температура і реакція середовища, оскільки одні з них активні в нейтральному середовищі(наприклад, ферменти слини), інші – в кислому(ферменти шлункового соку) або лужному(ферменти підшлункової залози). У разі нагрівання до температури понад 60°C багато ферментів інактивується(відбувається денатурація білків).
