Білки, їх будова, класифікація,властивості.
Білки — це органічні сполуки, полімери, мономерами в яких є амінокислоти.
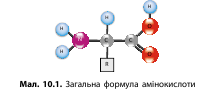
Амінокислоти—це невеликі за розміром органічні сполуки, у молекулі яких одночасно містяться аміногрупа й карбоксильна група. Ці амінокислоти мають загальну формулу де R — це радикал, який у кожної амінокислоти свій, а решта в молекулі амінокислот однакова.
Білок може являти собою один або декілька поліпептидів. До складу більшості білків входить 300—500 амінокислотних залишків, але є й більші білки, що складаються з понад 1500 амінокислот. Білки відрізняються кількістю амінокислот і порядком чергування їх у поліпептидному ланцюгу.
Білок може являти собою один або декілька поліпептидів. До складу більшості білків входить 300—500 амінокислотних залишків, але є й більші білки, що складаються з понад 1500 амінокислот. Білки відрізняються кількістю амінокислот і порядком чергування їх у поліпептидному ланцюгу.
Рівні організації білкової молекули
Білкова молекула має складну структуру.
Первинна структура білка представлена поліпептидним ланцюгом. У первинній структурі всі зв’язки між амінокислотами ковалентні, а отже, міцні. Первинною структурою білка називають кількість і послідовність амінокислот у поліпептидному ланцюгу.
Вторинна структура білка — це спосіб упакування первинної структури в альфаспіраль або беташар .
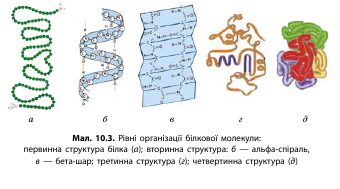
Альфаспіраль виникає в результаті утворення водневих зв’язків між групами —СО та —NH, розташованими на різних витках спіралі . Беташар утворюється в результаті формування водневих зв’язків між COгрупами одного поліпептидного ланцюга та NHгрупами іншого поліпептидного ланцюга. Унаслідок цього велика кількість поліпептидних ланцюгів може розташовуватися поряд, формуючи беташар.
Наступний рівень упакування білкової молекули — третинний, характерний для білків, у яких вторинна структура представлена альфаспіраллю (. У білків, що мають беташар, третинна структура не виражена.
Третинна структура білка — це спосіб упакування альфаспіралі у просторову глобулу. Третинна структура білка утворюється завдяки додатковим водневим зв’язкам, гідрофільногідрофобним взаємодіям та ковалентним дисульфідним зв’язкам —S—S—, які виникають між двома молекулами цистеїну.
Спосіб спільного упакування декількох поліпептидних ланцюгів називають четвертинною структурою білка. Наприклад, молекула гемоглобіну — білка, що міститься в еритроцитах,— складається з чотирьох поліпептидних ланцюгів, кожен з яких з’єднується із ферумовмісним гемом (гем — небілкова частина гемоглобіну). У результаті їх об’єднання й утворюється молекула гемоглобіну, що здатна здійснювати транспортування газів.
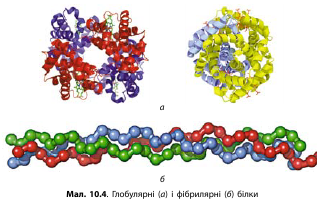
Якщо поліпептидні ланцюги лежать у вигляді клубка, то такі білки називають глобулярними. Якщо поліпептидні ланцюги лежать у пучках ниток, вони мають назву фібрилярних білків
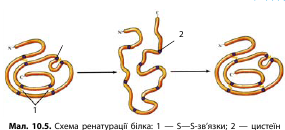
Денатурація та ренатурація білка
Починаючи зі вторинної структури, просторова конформація макромолекул білка підтримується переважно слабкими хімічними зв’язками. Під впливом зовнішніх чинників, наприклад зміни температури, складу солей у середовищі, pH, радіації, зв’язки, що утримують макромолекулу, рвуться і структура білка та його властивості змінюються. Цей процес називається денатурацією.
Денатурація — це порушення природної структури білка.
Якщо порушуються всі структури білка, включаючи первинну, така денатурація називається необоротною. Але бувають і процеси оборотної денатурації. За умови збереження первинної структури білка після усунення чинника, що призвів до денатурації, багато білків здатні повернути свою природну форму. Такий процес називається ренатурацією