
- •Введение
- •Лекция 1. Нулевое начало термодинамики
- •1.1. Основные определения химической термодинамики. 1.2. Нулевое начало термодинамики.
- •1.1. Основные определения химической термодинамики
- •1.2. Нулевое начало термодинамики
- •Лекция 2. Первое начало термодинамики. Термохимия.
- •2.1. Внутренняя энергия, теплота и работа
- •2.2. Первое начало термодинамики
- •2.3. Применение первого начала термодинамики к химическим реакциям
- •2.4. Термохимия. Закон Гесса
- •2.5. Теплоемкость. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •Лекция 3. Второе начало термодинамики. Энтропия.
- •3.1. Второе начало термодинамики. 3.2. Необратимые процессы. Изменение энтропии в разных процессах. 3.3. Энергии Гиббса и Гельмгольца.
- •3.1. Второе начало термодинамики
- •3.2. Необратимые процессы. Изменение энтропии в разных процессах
- •3.3. Энергии Гиббса и Гельмгольца
- •Лекция 4. Третье начало термодинамики.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений. 4.2. Энтропия и термодинамическая вероятность.
- •4.1. Третье начало термодинамики. Абсолютные энтропии химических соединений
- •4.2. Энтропия и термодинамическая вероятность
- •Лекция 5. Дисперсность и классификация коллоидных систем
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов. 5.2. Дисперсность коллоидных систем. 5.3. Классификация коллоидных систем.
- •5.1. Предмет коллоидной химии. Общие свойства коллоидных растворов
- •5.2. Дисперсность коллоидных систем
- •5.3. Классификация коллоидных систем
- •Лекция 6. Адсорбция
- •6.1. Основные определения. Изотерма адсорбции. 6.2. Уравнение Гиббса. 6.3. Поверхностно-активные вещества. 6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •6.1. Основные определения. Изотерма адсорбции
- •6.2. Уравнение Гиббса
- •6.3. Поверхностно-активные вещества
- •6.4. Правило Дюкло-Траубе. Уравнение Шишковского.
- •Лекция 7. Электрокинетические свойства коллоидных систем
- •7.1. Виды электрокинетических явлений. 7.2. Двойной электрический слой и ζ-потенциал.
- •7.1. Виды электрокинетических явлений
- •7.2. Двойной электрический слой и ζ-потенциал
- •Литература
- •Содержание
6.2. Уравнение Гиббса
Уравнение адсорбции Гиббса (1876 г.) устанавливает связь между избытком адсорбированного вещества в поверхностном слое Г, концентрацией поверхностно-активного вещества (ПАВ) в растворе с и поверхностным натяжением σ на границе раствор - газ:
![]() (6.4)
(6.4)
Из уравнения Гиббса
ясно, что если σ
увеличивается с увеличением концентрации
(с),
т. е.
![]() >0, то Г<0, иначе говоря, концентрация
растворенного вещества в поверхностном
слое меньше, чем в объеме раствора
(отрицательная адсорбция).
>0, то Г<0, иначе говоря, концентрация
растворенного вещества в поверхностном
слое меньше, чем в объеме раствора
(отрицательная адсорбция).
Наоборот, если σ уменьшится с увеличением (с), т. е, < 0, то Г>0 и концентрация растворенного вещества в поверхностном слое больше, чем в объеме раствора (положительная адсорбция). И если σ не зависит от (с), то = 0, то Г=0, т. е. концентрация растворенного вещества в поверхностном слое и объеме одинакова (адсорбция не наблюдается).
Величина
![]() называется поверхностной активностью.
Взятая на почти прямолинейном участке
изотермы σ,
когда концентрация ПАВ невелика и ее
значение постоянно, она может служить
мерой поверхностной активности данного
вещества. В честь Гиббса величину
обозначают G и называют гиббсом.
называется поверхностной активностью.
Взятая на почти прямолинейном участке
изотермы σ,
когда концентрация ПАВ невелика и ее
значение постоянно, она может служить
мерой поверхностной активности данного
вещества. В честь Гиббса величину
обозначают G и называют гиббсом.
![]() (6.5)
(6.5)
Пользуясь уравнением Гиббса, по изотерме поверхностного натяжения легко построить соответствующую изотерму адсорбции следующим образом (рис. 5.2).
Возьмем какую-нибудь
точку на изотерме σ
и проведем через нее касательную и
прямые параллельные осям координат.
Отрезок, отсекаемый на оси ординат
касательной и прямой, параллельной оси
абсцисс (z), деленный на отрезок абсциссы,
отсекаемый на ней прямой, проведенный
через точку параллельно оси ординат,
равен
,
т. е.
![]()
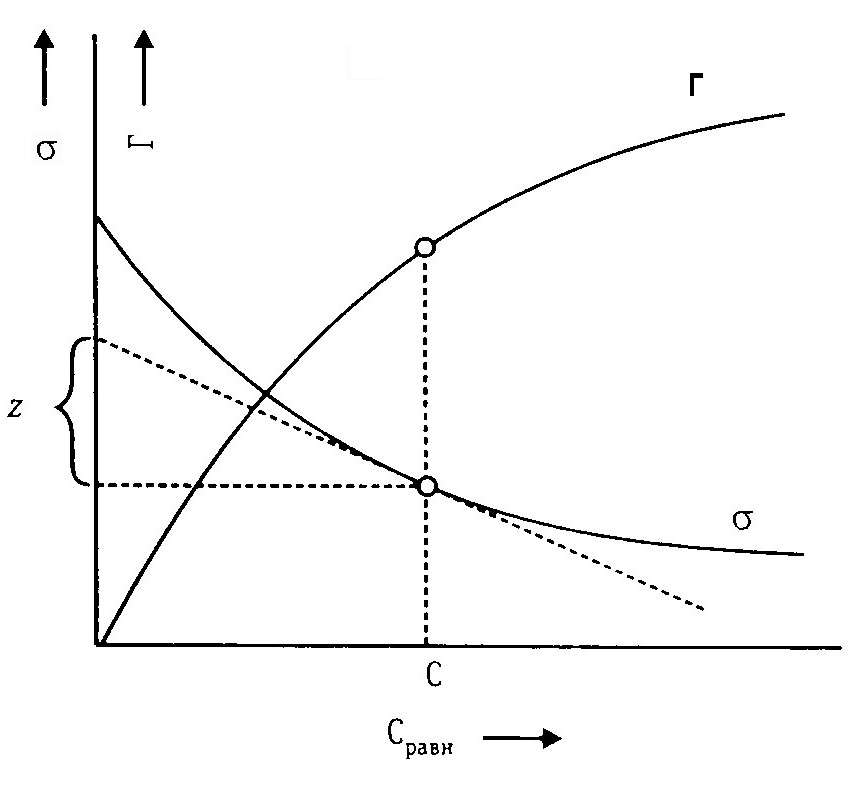
Рис. 6.2
Подставим значение, найденное для , в уравнение Гиббса, получим:
![]()
Определив для ряда точек изотермы σ соответствующие значения величины Г, легко построить изотерму адсорбции.
6.3. Поверхностно-активные вещества
Для рассмотрения явлений адсорбции растворенного вещества на границе раствор - газ молекулярно-кинетические представления мало пригодны. Здесь гораздо целесообразнее рассматривать явления с термодинамической позиции и связывать адсорбцию растворенного вещества с изменением свободной энергии поверхности или ее поверхностного натяжения.
Все растворимые вещества по их способности адсорбироваться на границе жидкость - воздух можно разделить на две группы: поверхностно-активные вещества (ПАВ) и поверхностно-инактивные вещества.
Поверхностно-активные вещества (ПАВ) способны накапливаться в поверхностном слое, и, следовательно, при этом должна происходить положительная адсорбция, т. е. Г>0. ПАВ должны обладать поверхностным натяжением, меньшим поверхностного натяжения растворителя (иначе накопление вещества в поверхностном слое термодинамически невыгодно), и сравнительно малой растворимостью. Иначе говоря, взаимодействие между молекулами ПАВ и молекулами растворителя всегда меньше взаимодействия между молекулами растворителя. В результате накопления на поверхности раствора молекул этих веществ, слабо взаимодействующих друг с другом, межмолекулярное взаимодействие в поверхностном слое уменьшится и поверхностное натяжение падает.
Поверхностно-активными веществами относительно воды являются многие органические соединения: жирные кислоты с достаточно длинным углеводородным радикалом, соли этих жирных кислот (мыла), сульфокислоты и их соли, спирты, амины. Характерной особенностью строения молекул большинства ПАВ является их дифильность, т. е. строение молекулы из двух частей - полярной группы и неполярного углеводородного радикала. Дифильные молекулы принято изображать символом, в котором полярная группа обозначается кружочком, а черточкой неполярный радикал:
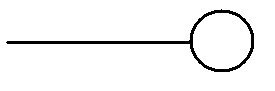
Обладающая значительным дипольным моментом и хорошо гидратирующаяся полярная группа обусловливает сродство ПАВ к воде. Гидрофобный углеводородный радикал является причиной пониженной растворимости этих соединений. Наименьшее значение поверхностного натяжения водного раствора ПАВ может достигать 25 мДж/м2, т. е. почти равняться поверхностному натяжению углеводородов.
Поверхностно-инактивные вещества стремятся уйти с поверхности жидкости в объем, в результате чего происходит отрицательная адсорбция, т. е. Г<0. Они обладают большим, чем у растворителя, поверхностным натяжением и высокой растворимостью. Другими словами, взаимодействие между молекулами поверхностно-инактивного вещества и растворителя больше, чем взаимодействие между молекулами растворителя, поэтому эти молекулы стремятся перейти в объем раствора. Поверхностно-инактивными веществами по отношению к воде является все неорганические электролиты - кислоты, щелочи, соли, которые распадаются в воде на хорошо гидратированные ионы.
Вещества, не влияющие на поверхностное натяжение растворителя, распределяются равномерно между поверхностным слоем и объемом раствора, следовательно, для них Г = 0. Для воды это сахара.
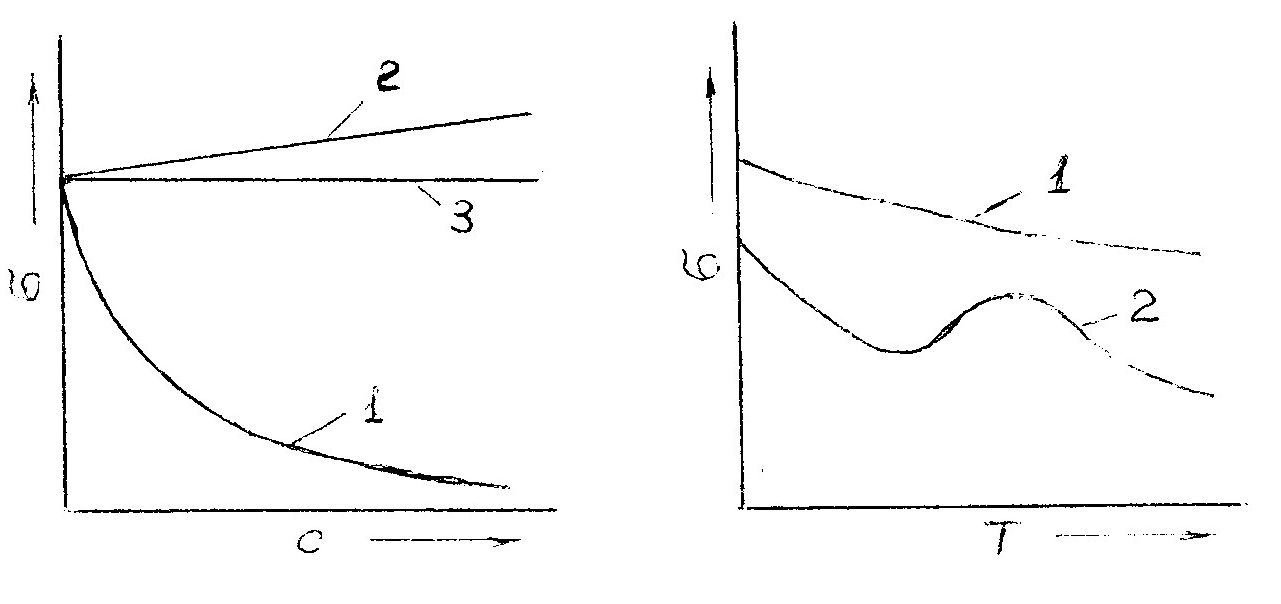
Рис. 6.3 Рис. 6.4
На рис. 6.3 приведены изотермы поверхностного натяжения, т. е. кривые зависимости а от концентрации вещества при Т = const. При повышении концентрации ПАВ (кривая 1) изотерма сначала круто падает почти по прямой. Это определяется тем, что вначале вся поверхность раздела жидкость - воздух свободна от ПАВ и небольшие его количества, присутствующие в растворе, почти целиком уходят на поверхность. Затем следует криволинейный участок, отвечающий средним концентрациям ПАВ. В этих условиях значительная часть поверхности уже занята молекулами ПАВ, что снижает дальнейшую его адсорбцию. Наконец, большим концентрациям ПАВ на изотерме отвечает почти горизонтальный участок, показывающий, что σ мало зависит от концентрации ПАВ. При этих условиях на поверхности жидкости образуется сплошной мономолекулярный слой поверхностно-активного вещества и дальнейшая адсорбция уже невозможна.
При повышении концентрации поверхностно-инактивного вещества в растворе (кривая 2) изотерма полого поднимается. Это говорит о том, что на границе раздела жидкость - воздух имеется лишь сравнительно небольшая часть этого вещества, попадающая туда в результате диффузии из объема раствора.
Наконец, кривая 3 характерна для растворов веществ, не влияющих на поверхностное натяжение.
Поверхностное натяжение индивидуальных веществ монотонно уменьшается с температурой (кривая 1, рис. 6.4). Поверхностное натяжение растворов некоторых ПАВ с повышением температуры может изменяться по кривой с максимумом (кривая 2). Максимум объясняется десорбцией ПАВ в определенном интервале температуры.
