Глюкокиназа.
Фосфорилирование глюкозы в гепатоцитах в период пищеварения обеспечивается свойствами глюкокиназы, которая имеет высокое значение КМ – 10 ммоль/л. В этот период концентрация глюкозы в воротной вене больше, чем в других отделах кровяного русла и может превышать 10 ммоль/л, а следовательно, активность глюкокиназы в гепатоцитах повышается. Следует отметить, что активность глюкокиназы, в отличие от гексокиназы, не ингибируется продуктом катализируемой реакции – глюкозо-6-фосфатом. Это обстоятельство обеспечивает повышение концентрации глюкозы в клетке в фосфорилиро ванной форме, соответственно её уровню в крови. Как уже упоминалось, глюкоза проникает в гепатоциты путём облегчённой диффузии при участии транспортёра ГЛЮТ-2 (независимого от инсулина). ГЛЮТ-2, так же, как глюкокиназа, имеет высокую КМ, что способствует повышению скорости поступления глюкозы в гепатоциты в период пищеварения, следовательно, ускоряет её фосфорилирование и дальнейшее использование для депонирования.
Хотя инсулин и не влияет на транспорт глюкозы, он усиливает приток глюкозы в гепатоциты в период пищеварения косвенным путём, индуцируя синтез глюкокиназы и ускоряя тем самым фосфорилирование глюкозы.
Преимущественное потребление глюкозы гепатоцитами, обусловленное свойствами глюкокиназы, предотвращает чрезмерное повышение её концентрации в крови в абсорбтивном периоде. Это, в свою очередь, снижает последствия протекания нежелательных реакций с участием глюкозы, например гликозилирования белков.
Гексокиназа.
Отличается от глюкокиназы высоким сродством к глюкозе (КМ < 0,1 ммоль/л). Следовательно, этот фермент, в отличие от глюкокиназы, активен при низкой концентрации глюкозы в крови, что характерно для постабсорбтивного состояния. Печень в этот период поглощает гораздо меньше глюкозы, так как скорость её внутриклеточного фосфорилирования глюкокиназой резко снижается. Тогда как потребление глюкозы мозгом, эритроцитами и другими тканями обеспечивается активной в этих условиях гексокиназой. Фермент гексокиназа может катализировать фосфорилирование не только D-глюкозы, но и других гексоз, хотя и с меньшей скоростью. Активность гексокиназы изменяется в зависимости от потребностей клетки в энергии. В качестве регуляторов выступают соотношение АТФ/АДФ и внутриклеточный уровень глюкозо-6-фосфата (продукта катализируемой реакции). При снижении расхода энергии в клетке повышается уровень АТФ (относительно АДФ) и глюкозо-6-фосфа-та. В этом случае активность гексокиназы снижается, и, следовательно, уменьшается скорость поступления глюкозы в клетку.
Следует отметить, что в разных тканях гексокиназа присутствует в различных изоформах, отличающихся величиной КМ. Глюкокиназа печени (и почек) является изоформой IV (гексокиназа IV). В клетках мышц содержится гексокиназа II, а в клетках опухолевых тканей преобладает гексокиназа III, с более высоким, чем у гексокиназы II, сродством к глюкозе.
№ 9 Пациента с жалобами на боль в груди в течение 3 дней госпитализировали с подозрением на инфаркт миокарда. Результаты биохимического анализа крови подтвердили диагноз. Опишите метод энзимодиагностики и объясните:
а) Какие особенности состава и распределения ферментов лежат в основе метода энзимодиагностики;
б) Активность каких ферментов определяли в крови пациента и для какого из этих ферментов она была наибольшей на третьи сутки болезни, напишите реакции, катализируемыми этими ферментами.
а) Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутри клеточных ферментов повреждённых клеток;
количество высвобождаемого фермента достаточно для его обнаружения;
активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
существуют различия во внутриклеточной локализации ряда ферментов.
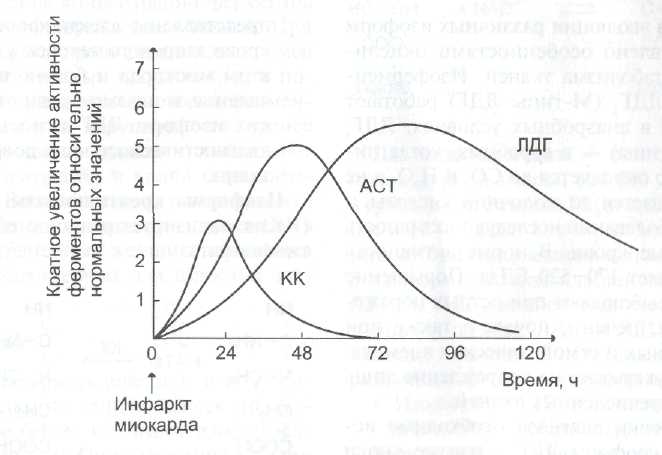
б) При инфаркте миокарда наблюдают достоверные изменения в крови активности ферментов КК, ЛДГ и аспартатаминотрансферазы – АСТ, которые зависят от времени, прошедшего от начала развития инфаркта и от зоны тканевого повреждения. После закупорки (окклюзии) коронарного сосуда в крови вначале отмечают повышение активности КК изоформы МВ, однако фермент быстро удаляется из кровотока. Обнаружение повышенной активности КК в плазме крови – основной энзимодиагностический критерий инфаркта миокарда. Если у пациента с загрудинными болями не обнаружено изменения в активности КК, диагноз инфаркта миокарда маловероятен.

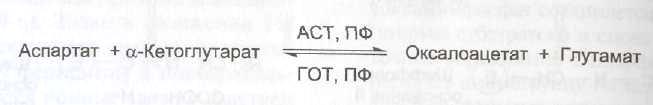
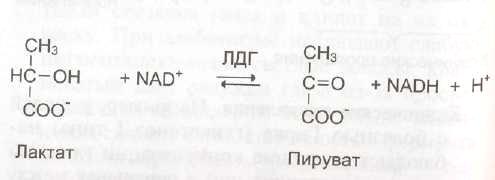
Дополнительным подтверждением диагноза инфаркта миокарда служит обнаружение активностей ферментов АСТ и ЛДГ в крови больных. Динамика изменений этих активностей также представлена на этом рисунке. Активность АСТ в норме составляет 5-40 МЕ/л. При инфаркте миокарда активность АСТ повышается через 4-6 ч, максимум активности наблюдают в течение 2-3 дней. Уровень ЛДГ также увеличивается в крови через несколько часов после закупорки кровеносного сосуда; максимум активности наблюдают на 3-4-й день, затем наступает постепенная нормализация активности. Уровень повышения активности ЛДГ коррелирует с размерами повреждения сердечной мышцы.