
- •Астраханский государственный технический университет
- •Петрофизические основы гис
- •Введение
- •Глава 1. Характеристики порового пространства горных пород.
- •Глава 2: Глинистость осадочных горных пород
- •Глава 3: Флюидонасыщенность горных пород
- •3.1 Водонасыщение горных пород
- •3.2 Нефтегазонасыщение горных пород
- •Глава 4: Плотность горных пород
- •Глава 5: Водородосодержание
- •Глава 6: Проницаемость
- •Глава 7: Электрические свойства горных пород
- •7.1 Удельное электрическое сопротивление
- •7.1.1 Удельное сопротивление гидрофобных водонасыщенных пород
- •7.1.2 Удельное электрическое сопротивление гидрофильных водонасыщенных пород
- •7.1.3 Удельное электрическое сопротивление пород с трещинной и каверновой пористостью
- •7.1.4 Удельное электрическое сопротивление нефтегазонасыщенных пород
- •7.2 Самопроизвольная электрохимическая активность горных пород
- •7.3 Вызванная электрохимическая активность
- •Глава 8: Магнитные свойства горных пород
- •Глава 9: Радиоактивные свойства горных пород
- •9.1 Естественная радиоактивность
- •9.2 Взаимодействие гамма-излучения с веществом.
- •9.3 Нейтронные свойства горных пород
- •Глава 10: Упругие свойства горных пород
- •Глава 11: Тепловые свойства горных пород
- •Глава 12: Общие закономерности распределениЯ физических свойств горных пород.
- •Глава 13. Классификация коллекторов нефти и газа.
- •Список литературы
- •Классификация пород по коэффициенту общей пористости [4]
- •Фильтрующие свойства основных типов горных пород [21]
- •Классификация песчано-алевритовых пород-коллекторов [22]
- •Параметры плотности и пористости [2]
- •Параметры упругости [2]
- •Магнитные параметры [2]
- •Электрические параметры [2]
- •Теплофизические параметры [2]
- •Класс коллектора по составу основной компоненты твёрдой фазы. [11]
- •Класс коллектора по преобладающему типу пористости горной породы. [11]
- •Класс коллектора по величине медианного диаметра зёрен для песчано-глинистых коллекторов [11]
- •Класс коллектора по величине медианного диаметра зёрен для карбонатных коллекторов [11]
- •Класс коллектора по степени цементации коллектора [11]
- •Класс коллектора по величине относительной глинистости [11]
- •Класс коллектора по характеристике порового пространства [11]
- •Класс коллектора по величине проницаемости коллектора[11]
- •Класс коллектора по величине общей и эффективной мощности коллектора [11]
- •Класс коллектора по величине нефтегазонасыщения и водонасыщения коллектора [11]
- •Класс коллектора по степени однородности коллектора [11]
- •Класс коллектора по параметру эффективности коллектора [11]
- •Класс коллектора по степени удельной и удельной эффективной ёмкости коллектора [11]
- •Класс коллектора по величине удельного массового нефтесодержания коллектора [11]
- •Класс коллектора по величине коэффициента вытеснения нефти[11]
- •Класс коллектора по максимально возможному промышленному удельному нефтесодержанию [11]
7.2 Самопроизвольная электрохимическая активность горных пород
Электрохимические процессы, протекающие в горных породах, вызывают их поляризацию.
Поляризация - это явление образования или ориентации электрических моментов молекул вещества в направлении электрического поля вследствие взаимного смещения заряженных частиц образующих молекулы.
Самопроизвольная поляризация в ионопроводящих породах с развитой межфазовой поверхностью возникает под действием естественных электрохимических процессов:
диффузионно-адсорбционных,
фильтрационных,
окислительно-восстановительных.
В зависимости от фактора, вызывающего поляризацию, различают диффузионно-адсорбционную, фильтрационную и окислительно-восстановительную поляризацию.
Окислительно-восстановительная поляризация для осадочных пород имеет подчиненное значение. Она наиболее активно проявляется при наличии минералов с электронной проводимостью. Обусловливается процессами электродной поляризации и окислительно-восстановительными реакциями, происходящими на границе электронно-проводящего минерала (например, рудные минералы) и окружающей средой.
Диффузионно-адсорбционная поляризация. Водные растворы солей представляют собой электролиты, содержащие положительно и отрицательно заряженные ионы. На контакте двух электролитов разной концентрации, вследствие различной электролитической подвижности их ионов, возникают диффузионные потенциалы под действием процесса диффузии (рис. 4).
Диффузия это процесс выравнивания концентраций двух веществ при их смешении друг с другом.
Электродвижущие силы (ЭДС) диффузии этих потенциалов в случае контакта простых и не отличающихся по химическому составу электролитов оцениваются уравнением Нернста:
![]() (7.19),
(7.19),
где
![]() универсальная газовая постоянная [8,314
Дж/(моль×Кл)];
универсальная газовая постоянная [8,314
Дж/(моль×Кл)];
![]() - число Фарадея (96500 Кл/моль); Т
— абсолютная температура (в К);
- число Фарадея (96500 Кл/моль); Т
— абсолютная температура (в К);
![]() и
и
![]() — числа катионов и анионов, на которые
диссоциирует одна молекула электролита;
— числа катионов и анионов, на которые
диссоциирует одна молекула электролита;
![]() и
и
![]() — валентности катиона и аниона; и
— валентности катиона и аниона; и
![]() — электролитические подвижности катиона
и аниона (в Ом×см2/моль);
С1
и С2
— концентрации контактирующих
электролитов (в моль/л) ( С1>С2
), тогда Ед
определяет потенциал второго электролита
по отношению к потенциалу первого,
— электролитические подвижности катиона
и аниона (в Ом×см2/моль);
С1
и С2
— концентрации контактирующих
электролитов (в моль/л) ( С1>С2
), тогда Ед
определяет потенциал второго электролита
по отношению к потенциалу первого,
![]() ,
,
![]() -
числа переноса катионов и анионов.
Число переноса характеризует относительную
подвижность или скорость движения
аниона, либо катиона (при сумме их
скоростей, равной единице) и ту долю
общего количества электричества,
прошедшего через электролит, которая
будет перенесена соответственно анионом
или катионом.
-
числа переноса катионов и анионов.
Число переноса характеризует относительную
подвижность или скорость движения
аниона, либо катиона (при сумме их
скоростей, равной единице) и ту долю
общего количества электричества,
прошедшего через электролит, которая
будет перенесена соответственно анионом
или катионом.
Из формулы (7.19) следует, что диффузионные ЭДС возникают лишь при условии, если число переноса анионов и катионов разное или существует различие концентраций контактирующих растворов.
Например для
одновалентного электролита, каким
является раствор NаСl![]() Na
++Cl-,
ион Сl—
примерно в 1,5 раза подвижнее иона Nа+,
вследствие чего раствор с концентрацией
С2
< С1
заряжается отрицательно.
Na
++Cl-,
ион Сl—
примерно в 1,5 раза подвижнее иона Nа+,
вследствие чего раствор с концентрацией
С2
< С1
заряжается отрицательно.
С учетом числовых значений констант R и F, замены натурального логарифма десятичным при Т = 291 К в из формулы 7.19 величина диффузионной ЭДС ( мВ) лпределится выражением :
![]() (7.20)
(7.20)
Величина Kд называется коэффициентом диффузионной ЭДС и зависит от температуры и химического состава контактирующих электролитов. Как следует из выражения 7.20 для раствора NаСl при Т — 18 °С подвижность катиона Nа+ составляет 43,3, аниона Сl- - 65,2 , величина Kд = 11,6 мВ.
Формула (7.20) справедлива для растворов низкой концентрации, в которых практически отсутствует взаимодействие между ионами. Для реальных растворов в формуле (7.20) необходимо использовать вместо концентрации С1 и С2 коэффициенты активностей a1=f1С1, a2=f2С2, где f1, f2 учитывающие влияние сил взаимодействия между ионами в реальных растворах. В этом случае:
![]() (7.21).
(7.21).
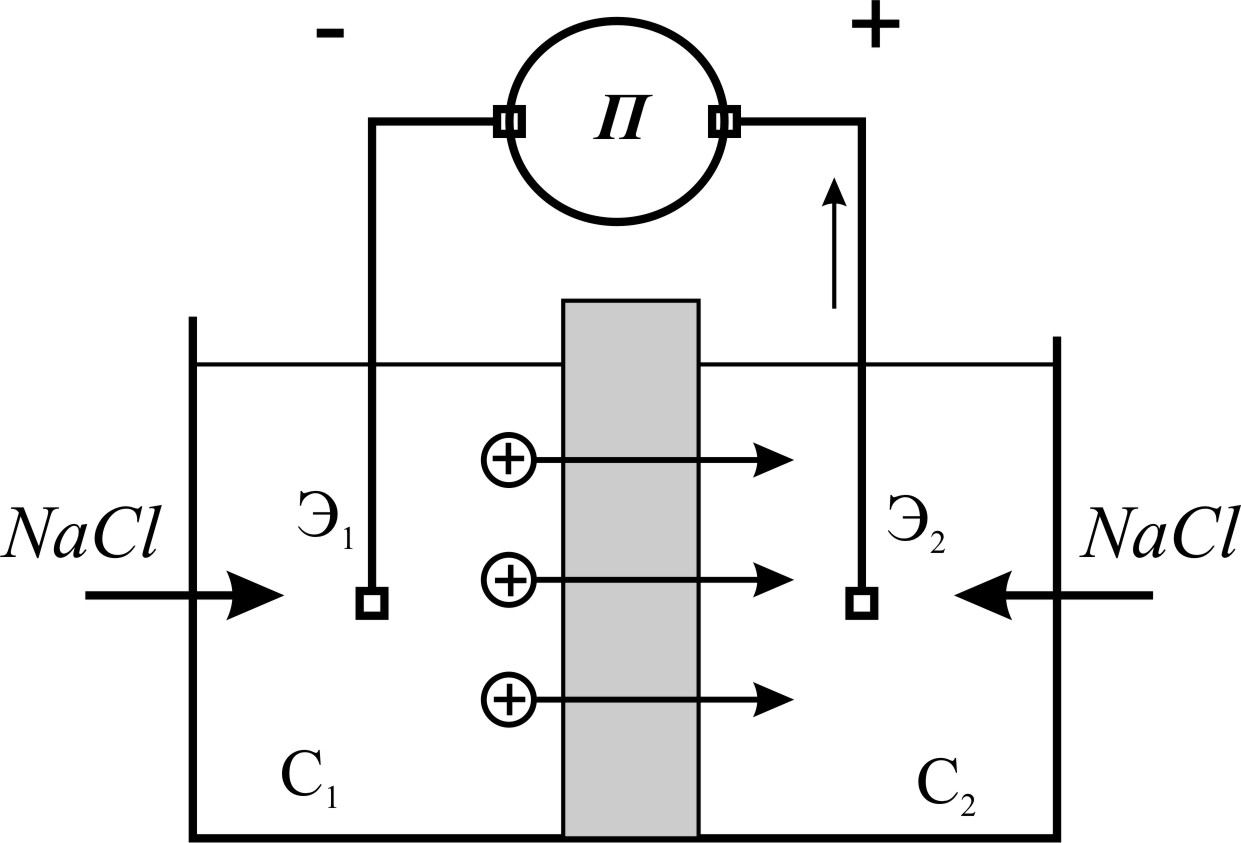
Рис. 4. Схема возникновения диффузионных потенциалов на контакте двух электролитов С1 и С2 — концентрации двух растворов хлористого натрия (С1 > С2); П — измерительный прибор; Э1 и Э2 — электроды [3].
В значительных
пределах изменений концентраций
растворов, отношение
![]() коэффициентов активностей практически
равно обратному отношению удельных
электрических сопротивлений растворов
коэффициентов активностей практически
равно обратному отношению удельных
электрических сопротивлений растворов
![]() ,
следовательно, можно записать:
,
следовательно, можно записать:
![]() (7.22).
(7.22).
Для раствора NаСl диффузионный потенциалопределится выражением :
![]() (7.23).
(7.23).
Величина диффузионного потенциала для разных по химическому составу растворов различна. В частности, для растворов КСl, вследствие почти одинаковой подвижности ионов хлора и калия, диффузионный потенциал близок к нулю.
Адсорбция - это физико-химический процесс поглощения веществ из раствора или газа твёрдыми телами или жидкостями.
Диффузионно-адсорбционная Э.Д.С. возникает между растворами электролита различной концентрации С1 и С2 когда последние не контактируют непосредственно, а разделены пористой перегородкой из диэлектрика обладающего ионно-адсорбционной способностью.
Под ионно-сорбционной способностью понимается, свойство влажных пород избирательно адсорбировать из насыщающих электролитов, наряду с молекулами воды, ионы определенного знака и, вследствие этого, образовывать двойные электрические слой на границах раздела фаз. Двойной электрический слой состоит из потенциалопределяющего слоя ионов и слоя противоионов.
Потенциалопределяющий (адсорбционный) слой ионов прилегает наряду с молекулами прочно связанной воды непосредственно к поверхности минеральных частиц твердой фазы породы. Далее располагается прочно связанный с ним неподвижный слой противоионов и затем более рыхлый, менее прочно связанный и более подвижный диффузный слой. Между ионами адсорбционного и диффузного слоев происходит непрерывный равновесный обмен.
Это приводит к изменению диффузионных ЭДС как по величине, так и знаку. Электродвижущая сила, возникающая в цепи электролит (с концентрацией С1) — тонкодисперсная порода — тот же электролит с концентрацией С2, носит название диффузионно-адсорбционной (рис. 5). Ее величина при наличии двух растворов одинакового химического состава, но различной концентрации изменяется от значения диффузионной ЭДС до предельного, определяемого уравнением:
![]() (7.24),
(7.24),
где z— валентность электролита.
Уравнение справедливо при условии, что анионы неподвижны (V=0) и валентности катионов и анионов равны (zк = zа).
При Nк=1,
Nа=0
![]() =58,
получаем предельное значение
диффузионно-адсорбционной ЭДС:
=58,
получаем предельное значение
диффузионно-адсорбционной ЭДС:
![]() (7.25).
(7.25).
Для большинства растворов:
![]() (7.26),
(7.26),
где
![]() — коэффициент диффузионно-адсорбционной
ЭДС. Величина
в отличие от
— коэффициент диффузионно-адсорбционной
ЭДС. Величина
в отличие от
![]() зависит не только от температуры и
химического состава растворов, но и от
свойств породы, через которую происходит
контакт растворов.
зависит не только от температуры и
химического состава растворов, но и от
свойств породы, через которую происходит
контакт растворов.
Способность породы вызывать отличие диффузионно-адсорбционной Э.Д.С., измеряемой на образце породы, от диффузионной Э.Д.С. называется диффузионно-адсорбционной активностью АДА.
Численно
![]() и, следовательно:
и, следовательно:
![]() (7.27),
(7.27),
Из уравнения (7.27) вытекает, что диффузионно-адсорбционная активность:
 (7.28).
(7.28).
Таким образом, диффузионно-адсорбционные потенциалы, возникающие на границе пород с электролитами, могут существенно отличаться от диффузионных. Свойство же горных пород создавать, диффузионно-адсорбционные потенциалы, вследствие их способности адсорбировать из растворов наряду с молекулами воды ионы определенного знака, называется диффузионно-адсорбционной активностью.
Тесная связь между диффузионно-адсорбционной активностью АДА и ионно-сорбционной способностью пород характеризуется приведенной емкостью обмена qП
Приведенная емкость обмена (поглощения) характеризует число молей поглощенных катионов, приходящихся на единицу объема (м3, см3) порового пространства породы.
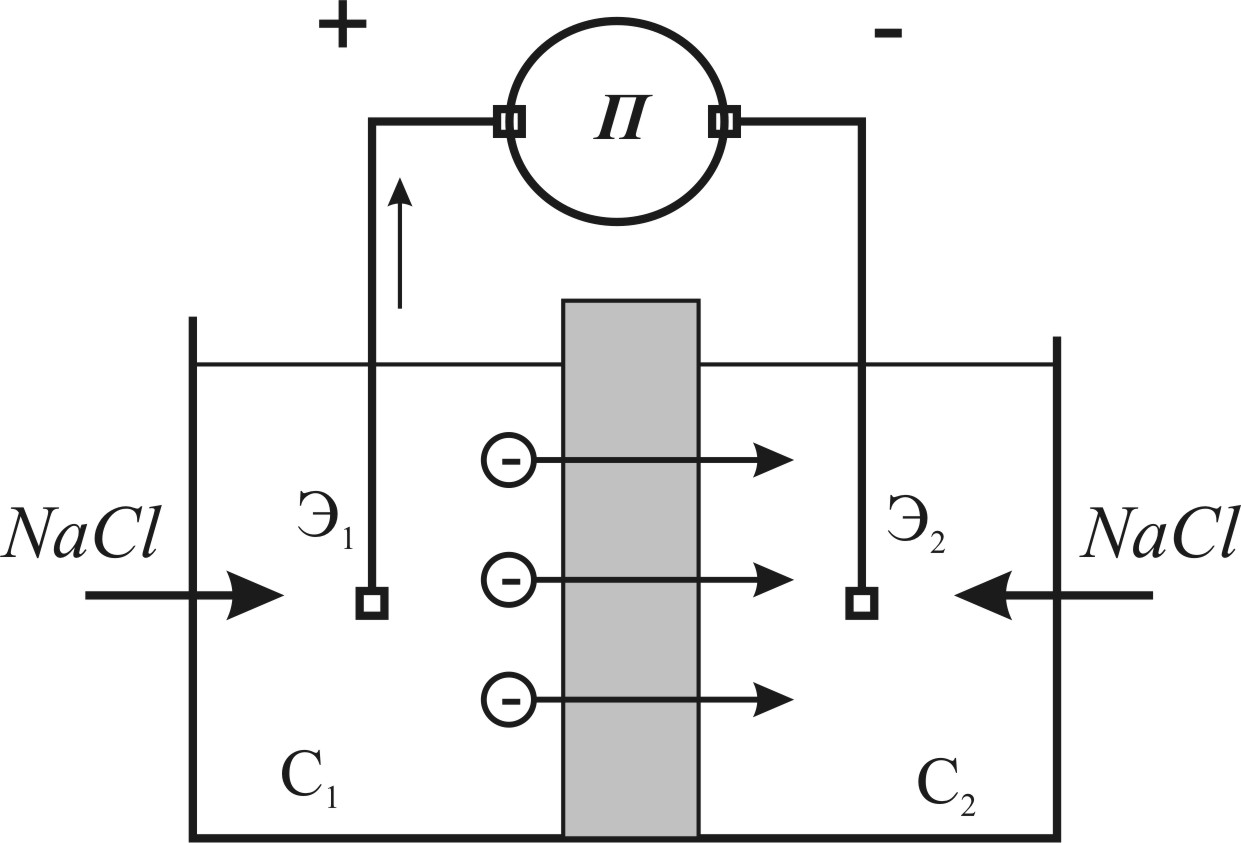
Рис. 5. Схема возникновения диффузионно-адсорбционных (мембранных) ЭДС, когда два раствора различной концентрации разделены тонкопористой (глинистой) перегородкой (С1 > С2) [3].
Для терригенных пород:
![]() (7.29),
(7.29),
где
![]() — плотность твердой фазы породы;
— плотность твердой фазы породы;
![]() — массовая емкость обмена, характеризующая
число молей поглощенных катионов на
единицу массы (кг, г) породы и зависящая
от химического состава жидкой и твердой
фаз, а также степени дисперсности
последней; (
— массовая емкость обмена, характеризующая
число молей поглощенных катионов на
единицу массы (кг, г) породы и зависящая
от химического состава жидкой и твердой
фаз, а также степени дисперсности
последней; (![]() — объемная емкость поглощения).
— объемная емкость поглощения).
Для карбонатных пород существует схожая зависимость.
Исследования образцов различных терригенных пород показали, что отличие диффузионно-адсорбционного потенциала от диффузионного тем больше, чем выше содержание в них глинистого материала.
Отличие диффузионно-адсорбционного потенциала тем больше, чем выше содержание в них глин [9] .
Величина Ада пород зависит не только от содержания в них глинистого, но и другого по вещественному составу цементирующего материала.
Наиболее высокой активностью характеризуется железисто-сидеритовый и глинисто-серицитовый цементы, меньшей — опалово-халцедоновый и карбонатный.
Влияние глинистости на величину Aда, обусловливает наличие зависимостей между диффузионно-адсорбционной активностью и коэффициентом относительной глинистости пород. Отмечаются значимые корреляционные связи между Ада и kпр, Ада и kп.
Численные значения диффузионно-адсорбционной активности для различных горных пород изменяются от — 11,6 до 70 мВ. Наименьшими величинами Ада обладают чистые разности песков, песчаников, алевролитов, пористых известняков и доломитов.
Фильтрационная поляризация. Фильтрационная поляризация возникает под действием фильтрационных потенциалов.
При фильтрации электролита (поровой воды) через капилляр конечной длины, между концами капилляра возникает фильтрационная Э.Д.С. - потенциалы течения.
Если толщина двойного электрического слоя мала по сравнению с радиусом капиллярного порового канала, величина фильтрационного потенциала определяется формулой Гельмгольца:
![]() (7.30),
(7.30),
где
![]() — диэлектрическая постоянная жидкости;
— удельное сопротивление фильтрующейся
жидкости;
— вязкость;
— диэлектрическая постоянная жидкости;
— удельное сопротивление фильтрующейся
жидкости;
— вязкость;
![]() —
избыточное давление, под действием
которого происходит фильтрация жидкости.
—
избыточное давление, под действием
которого происходит фильтрация жидкости.
![]() -электрокинетический
потенциал.
-электрокинетический
потенциал.
Согласно формуле
(7.30), величина фильтрационного потенциала
пропорциональна перепаду давлений
и удельному сопротивлению жидкости
.
С увеличением минерализации жидкости
значение Еф
уменьшается вследствие снижения величин
и
.
Параметры
![]() ,
и
,
входящие в формулу, являются положительными
при всех условиях и не изменяют знака
Еф.
Последний зависит от знака дзета-потенциала
и направления движения жидкости, т. е.
направления избыточного давления
.
,
и
,
входящие в формулу, являются положительными
при всех условиях и не изменяют знака
Еф.
Последний зависит от знака дзета-потенциала
и направления движения жидкости, т. е.
направления избыточного давления
.
Образование фильтрационного потенциала обусловлено наличием электрокинетического потенциала , на границе между подвижной и неподвижной частями двойного слоя и свободного раствора.
Механизм образования фильтрационных потенциалов схематично можно представить следующим образом. Под воздействием перепада давлений Δр в поровом канале происходит движение свободного раствора, заполняющего среднюю часть порового канала. Одновременно с ним в направлении течения перемещается и подвижная часть внешней диффузной обкладки двойного электрического слоя.
Это приводит к смещению электрокинетического потенциала в направлении течения, вследствие чего на концах капиллярного порового канала возникает разность потенциалов.
В общем случае величина фильтрационного потенциала для породы определяется следующей формулой:
![]() (7.31),
(7.31),
где Аф.п. — фильтрационная электрохимическая активность породы, зависящая от структуры порового пространства и свойств фильтрующейся жидкости.
Фильтрационные потенциалы значимы только для низкопроницаемых пород, с малыми размерами радиуса капилляров.
На контакте двух пород - коллектора и «неколлектора», суммарная величина фильтрационного потенциала будет определяться только фильтрационной способностью пласта «неколлектора» (глиной).
Установлено, что потенциалы фильтрации возникают в различных по своей литологии породах, в том числе и глинах. Однако наибольший интерес они представляют в породах-коллекторах, которые подвержены кольматации (закупорке) при бурении на глинистом растворе.
